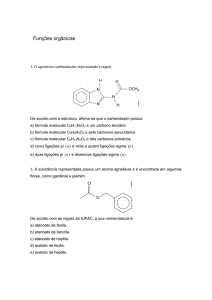
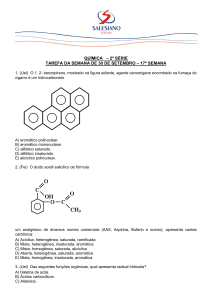
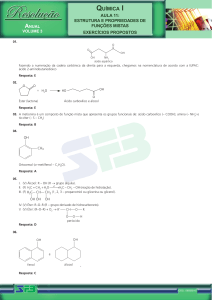
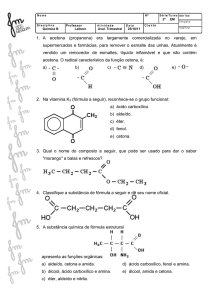
Exercícios de Química2 – professora Ana Edith-mix
1)Os frascos de quatro substâncias foram numerados de 1 a 4 e seus pontos de ebulição são
dados abaixo.
Frasco 1 – PE: 36oC
Frasco 2 – PE: 69oC
Frasco 3 – PE: 117oC
Frasco 4 – PE: 142oC
Sabendo que as substâncias desconhecidas são ácido propanoico, pentano, butanol e hexano,
assinale o que for correto.
( ) Os frascos de 1 a 4 contêm, respectivamente, pentano, butanol, ácido propanoico e hexano.
( ) O pentano tem o menor ponto de ebulição, pois suas moléculas se unem por forças de van
de Waals, que são pouco intensas.
( ) O ácido propanoico apresenta maior ponto de ebulição que o butanol, pois suas moléculas
unem-se por duas ligações de hidrogênio, dando origem a dímeros.
( ) O ponto de ebulição dos alcanos de cadeia linear aumenta gradativamente com o aumento
de suas massas moleculares.
( ) A quantidade de energia necessária para romper uma ligação de hidrogênio intermolecular
entre dois átomos é maior que a energia necessária para romper uma ligação covalente entre
os mesmos átomos.
2)O éter metílico e o álcool etílico apresentam a mesma massa molecular, são formados pelo
mesmo número de átomos e também apresentam a mesma fórmula molecular (C 2H6O).
Entretanto, as suas temperaturas de ebulição são muito diferentes, isto é: éter metílico = –25,0
°C e álcool etílico = 78,5 °C.
Assinale a alternativa que explica o fato do éter metílico e o álcool etílico apresentarem
diferenças na temperatura de ebulição.
(A) As moléculas do álcool etílico podem formar interações do tipo pontes de hidrogênio entre
si, enquanto as moléculas do éter metílico não podem.
(B) O álcool etílico contém água e portanto aumenta o seu ponto de ebulição.
(C) As moléculas do álcool etílico podem formar interações fortes do tipo Van der Waals entre
si, enquanto as moléculas do éter metílico não podem.
(D) As moléculas do álcool etílico podem formar interações fortes do tipo forças de London
entre si, enquanto as moléculas do éter metílico não podem.
(E) As moléculas do álcool etílico podem formar interações fortes do tipo dipolos induzidos
entre si, enquanto as moléculas do éter metílico não podem.
3) A temperatura de ebulição de uma substância depende, entre outros fatores, das interações
intermoleculares existentes entre suas moléculas.
Analise a estrutura destes três compostos, cujas massas molares são aproximadamente iguais:
I)
CH3COOH; ácido acético; (60 g/mol)
II) CH3CH2CH2OH; propanol; (60 g/mol)
III) CH3CH2CHO; propanal; (58 g/mol)
A partir dessas informações, assinale a alternativa em que esses três compostos estão
apresentados de acordo com a ordem decrescente de suas respectivas temperaturas de
ebulição.
(A) I > II > III
(B) I > III > II
(C) II > I > III
(D) III > I > II
(E) I = II < III
4) Um estudante recebeu uma tabela, reproduzida a seguir, em que constam os pontos de
ebulição de três compostos diferentes, à 1 atm.
Composto X – PE: -135oC
Composto Y – PE: 37oC
Composto Z – PE: 118oC
Segundo essa tabela, os possíveis compostos X, Y e Z podem ser, respectivamente,
(A) 1- butanol, butano e éter etílico.
(B) éter etílico, 1- butanol e butano.
(C) butano, éter etílico e 1- butanol.
(D) butano, 1- butanol e éter etílico.
(E) 1- butanol, éter etílico e butano.
5) Compostos orgânicos oxigenados como álcoois (ROH), cetonas (RCOR’), ésteres (RCOOR’)
e ácidos carboxílicos (RCOOH’) são bastante presentes em nosso cotidiano. Por exemplo,
etanol é usado como combustível para veículos, ácido acético é encontrado no vinagre,
acetona e acetato de metila servem para remover esmalte de unhas. As propriedades de
compostos dessas classes variam muito e a tabela ilustra alguns exemplos
Assinale a alternativa que explica corretamente as propriedades descritas nessa tabela.
(A) O ponto de ebulição do éster é menor que o ponto de ebulição da cetona, porque o maior
número de átomos de oxigênio presente na molécula do éster aumenta as interações dipolodipolo, que desfavorecem as interações entre suas moléculas.
(B) O ácido carboxílico é um composto polar e faz fortes ligações de hidrogênio entre suas
moléculas, o que explica o elevado ponto de ebulição.
(C) O éster é mais polar que o ácido, por isso há mais interações dipolo induzido entre suas
moléculas, o que explica o ponto de ebulição mais baixo observado para o éster.
(D) A cetona tem massa molecular menor que o ácido, por isso seu ponto de ebulição é menor.
(E) O álcool tem o menor ponto de fusão dentre os compostos listados, porque pode formar o
maior número de ligações hidrogênio, devido ao maior número de átomos de hidrogênio
presente em sua molécula.
6) As fórmulas apresentadas a seguir, numeradas de 1 a 6, correspondem a substâncias de
mesma fórmula molecular.
Determine a fórmula molecular dessas substâncias e escreva a fórmula estrutural completa do
álcool primário que apresenta carbono assimétrico (quiral).
7)Corantes e pigmentos são aditivos utilizados para dar cor a objetos. Os corantes são solúveis
no meio, enquanto os pigmentos são insolúveis.
Observe a fórmula estrutural da fluoresceína, insolúvel em água.
O sal orgânico monossódico formado a partir da reação química da fluoresceína com o
hidróxido de sódio é usado, no entanto, como corante têxtil.
Nomeie o grupo funcional da fluoresceína cuja reação formou esse sal. Em seguida, explique
por que o sal orgânico monossódico apresenta maior solubilidade em água do que a
fluoresceína.
8)Estatinas são fármacos utilizados no tratamento do colesterol elevado. Dentre as estatinas, a
sinvastatina é um pró-fármaco, pois é uma lactona (éster cíclico) que, após passar pelo fígado,
é convertido no hidróxi-ácido, que é um fármaco ativo. A seguir, é apresentada a fórmula
estrutural plana da sinvastatina (lactona).
Considerando-se o exposto,
a) escreva a fórmula estrutural do fármaco ativo;
b) determine o número de carbonos sp2 na molécula da sinvastatina
c)Dê sua equação termoquímica de combustão
Xote Ecológico
(Composição: Luiz Gonzaga)
Não posso respirar, não posso mais nadar
A terra está morrendo, não dá mais pra plantar
Se planta não nasce se nasce não dá
Até pinga da boa é difícil de encontrar
Cadê a flor que estava aqui?
Poluição comeu.
E o peixe que é do mar?
Poluição comeu
E o verde onde que está?
Poluição comeu
Nem o Chico Mendes sobreviveu
Do texto, a letra de música composta por Luiz Gonzaga, pode-se observar a preocupação do
autor com o meio ambiente e o efeito da degradação deste na qualidade de um produto
tipicamente brasileiro, a cachaça.
9) Dos produtos que podem ser componentes da cachaça, podem ser encontrados 1,4butanodiol, ácido acético, isobutanol e heptanoato de etila, A qual sequência de funções
orgânicas, respectivamente, pertencem estes compostos?
a) Fenol, éster carboxílico, enol e anidrido ácido.
b) Éster, éster carboxílico, fenol e éster.
c) Fenol, ácido carboxílico, álcool e éster.
d) Álcool, ácido carboxílico, álcool e éster.
e) Álcool, ácido carboxílico enol e sal de ácido carboxílico.
10) O aspartame é um adoçante artificial usado para adoçar bebidas e alimentos.
Abaixo está representada a sua fórmula estrutural.
Sobre essa estrutura, são feitas as seguintes afirmações:
I. As funções orgânicas existentes na molécula dessa substância são características, apenas,
de éter, amina, amida, ácido carboxílico e aldeído.
II. A fórmula molecular do aspartame é C13H15N2O5 .
III. A função amina presente na molécula do aspartame é classificada como primária, porque só
tem um hidrogênio substituído.
IV. A molécula de aspartame possui 7 carbonos com hibridização sp3 e 4 carbonos com
hibridização sp2 .
V. O aspartame possui 6 ligações π (pi) na sua estrutura.
Das afirmações feitas está(ão) corretas:
a) apenas I e III.
b) apenas II e III.
c) apenas III e V.
d) apenas II e IV.
e) apenas I e IV.