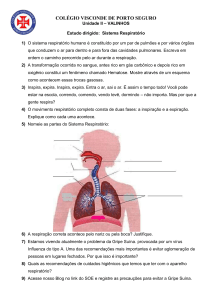
Procedimentos Técnicos
Código: PROMIC-0011-1
Versão: 01
Pg: 1/4
TÍTULO: Cultura do Trato respiratório Superior
ELABORADO POR
DE ACORDO
NOME
Dr. Renato de
Lacerda Barra
Filho
Dr. Ivo Fernandes
FUNÇÃO
ASSINATURA
Biomédico
01/10/2009
Gerente da Qualidade
Biomédico
20/10/2009
Dr. Jose Carlos
Diretor Executivo
dos Santos
HISTÓRICO DAS REVISÕES
Revisado por
Data
Assinatura
Aprovado por
APROVADO POR
Versão
Versão
1
Responsável
Ivo
DATA
REVALIDAÇÃO ANUAL
Data
Versão
01/10/2013
30/10/2009
Data
Responsável
Assinatura
Data
1. NOME/ SINONÍMIAS/ MNE
PESQUISA DE ESTREPTOCOCOS BETA-HEMOLÍTICO NA OROFARINGE; CULTURA DE
OROFARINGE, AMÍGDALAS, FARINGE E NASOFARINGE.
2. PRINCÍPIO DO TESTE
Isolar bactérias patogênicas de secreção do trato respiratório superior, especialmente estreptococos
beta-hemolítico do grupo “A”, uma vez que se faz necessária a terapia imediata em pacientes infectados
por patógenos deste grupo. A urgência não é justificada apenas pela doença básica (faringite,
amigdalite) mas também para evitar complicações posteriores, potencialmente graves como febre
reumática, glomerulonefrite e endocardite reumática. Também são pesquisados estreptococos dos
Grupos C e G e outra bactérias freqüentes no trato respiratório superior. O isolamento é realizado por
crescimento bacteriano em meio de cultura enriquecidos com sangue de carneiro desfibrinado, que
propicia o desenvolvimento e a caracterização presuntiva do patógeno de interesse pelo tipo de
hemólise produzida.
3. SIGNIFICADO CLÍNICO
Dentre as culturas do trato respiratório superior, as mais solicitadas são: cultura de orofaringe,
amígdala, faringe e nasofaringe. Outras culturas incluem: amostras seios maxilares para o diagnóstico
de sinusite, amostras da mucosa oral para o diagnóstico de candidíase oral, amostras de secreção
nasal para pesquisa de portadores de Staphylococcus aureus e Neisseria meningitidis, entre outras.
Os microorganismos mais freqüentemente isolados nesses sítios incluem: Streptococcus pyogenes,
estreptococos beta-hemolítico dos grupos C,F e G, Streptococcus pneumoniae, Moraxella catarrhalis,
Haemophilus influenzae, Staphylococcus aureus, enterobactérias e bacilos gram-negativos nãofermentadores.
4. COLETA E TRATAMENTO DA AMOSTRA
4.1. Coleta da amostra: Vide manual de coleta.
4.2. Tipos de amostra:
•
•
•
Orofaringe
Nasofaringe
Faringe
Procedimentos Técnicos
Código: PROMIC-0011-1
Versão: 01
Pg: 2/4
TÍTULO: Cultura do Trato respiratório Superior
•
•
•
•
4.3.
4.4.
4.5.
4.6.
Amígdalas
Secreção nasal
Punção de seios maxilares
Raspado de lesão da boca
Volume mínimo para análise: N/A
Rejeição de amostras: Vide manual de coleta.
Condições de acondicionamento; vide manual de coleta
Tratamento e pré-tratamento da amostra: N/A
5. MATERIAL REQUERIDO
•
•
•
•
•
•
•
•
•
•
•
Estufa bacteriológica;
Microscópio ótico;
Bico de Bunsen;
Placa estéril;
Alça calibrada;
Lâminas;
Jarra com vela;
Luvas de procedimento;
Máscara;
Óculos de segurança;
Swab estéril.
6. REAGENTES
•
Placa de Ágar Sangue (AS) - pronto para uso.
•
Caldo BHI - preparado.
•
Mac Conkey – pronto para uso.
7. PROCEDIMENTO DETALHADO
7.1. Bacterioscopia:
• Para diagnóstico de candidíase oral
A infecção por levedura da mucosa oral é geralmente causada pela Cândida albicans,
principalmente em recém-nascidos e adultos debilitados. Outras espécies também podem estar
envolvidas. O diagnóstico pode ser realizado por exame direto da amostra clínica.
- Coletar amostra da lesão com “swab” e introduzi-lo em 0.5 mL de solução
fisiológica estéril.
- Preparar uma lâmina a partir da solução homogeneizada e cobrir com lamínula.
Observar ao microscópio a presença de células leveduriformes.
7.2. Semeadura e Isolamento:
7.2.1.
SEMEADURA:
•
Rolar o “swab” em uma pequena área de uma placa de AS e MC.
•
Estriar com auxílio de uma alça bacteriológica em três direções próximas uma da
outra para obter colônias isoladas.
Procedimentos Técnicos
Código: PROMIC-0011-1
Versão: 01
Pg: 3/4
TÍTULO: Cultura do Trato respiratório Superior
•
7.2.2.
Para a amostra de secreção nasal, colocar o “swab” após semeadura em um caldo
BHI.
INCUBAÇÃO:
•
7.2.3.
BHI, AS e MC -em estufa a 36 + 1ºC por 18 a 48 horas.
AVALIAÇÃO DAS CULTURAS:
Após 18-24 horas de incubação, realizar a primeira leitura das placas para verificar a
presença dos microorganismos considerando os mais importantes naquele material clínico e
suspeita diagnóstica.
Nota: em pacientes imunodeprimidos, bacilos gram-negativos devem ser considerados.
7.2.3.1. COLÔNIAS BETA-HEMOLÍTICAS
•
Se não houver colônias isoladas em quantidade suficiente para realização dos testes,
reisolar uma única colônia em um novo AS. Incubar em estufa por 18-24 horas.
8. CÁLCULOS/ LIBERAÇÃO DOS RESULTADOS
Resultado Negativo: não houve crescimento de microorganismos.
Resultado Positivo: reportar cada microorganismo isolado (Consultar POP de identificação), realizar
antibiograma (vide POP de antibiograma) com exceção de cultura de orofaringe.
Obs.:Quando o material for semeado à partir de um meio de transporte ou nos casos dos isolamentos
de patógenos apenas após o enriquecimento em caldo THIO não deverá reportar a quantificação
da amostra.
9. CONTROLE DE QUALIDADE
Os meios de cultura utilizados devem ser controlados para verificar se os microorganismos mais
freqüentemente isolados nestes materiais clínicos apresentam bom crescimento. Vide Plano de
Qualidade.
10. INTERVALO DE REFERÊNCIA
N/A
11. INTERVALO CRÍTICO
N/A
12. CONFIABILIDADE ANALÍTICA
Correlacionar o resultado da cultura (quantidade de bactérias do isolamento primário) com o Gram
(presença de polimorfonucleares e bactérias). Esta conduta é importante para melhor determinar o
significado clínico dos isolamentos bacterianos que poderiam ser considerados da microbiota normal.
13. INTERFERENTES
Procedimentos Técnicos
Código: PROMIC-0011-1
Versão: 01
Pg: 4/4
TÍTULO: Cultura do Trato respiratório Superior
Qualquer antibiótico administrado previamente à coleta poderá fornecer resultados falso-negativos. A
amostra coletada pode muitas vezes estar contaminada por bactérias da flora normal (por exemplo:
estafilococos coagulase negativa). A presença deste tipo de patógeno deve ser analisada com critério
levando-se em consideração outras características do paciente como por exemplo o seu estado
imunológico.
14. INTERVENÇÕES
N/A
15. REFERÊNCIAS BIBLIOGRÁFICAS
1.
Oplustil P.; Carmen; Zoccoli M,;Cássia; Tobouti R.;Nina; Sinto I.;Sumiko – Procedimentos
Básicos em Microbiologia Clínica – 1ªEdição – Sarvier, 2000.
2. Murray.R. Patrick ; Baron, J. Ellen; Pfaller, A. Michael; Tenover, C. Fred; Yolken, H. Robert. –
Manual of Clinical Microbiology – 7ª Edição – American Society for Microbiology, 1999.
3. Koneman, W. Elmer; Allen, D. Stephen; Janda, M. William; Schreckenberger, C. Paul; Winn,
C. Washington Jr. – Diagnóstico Microbiológico – 5ª Edição – MEDSI – 2001.