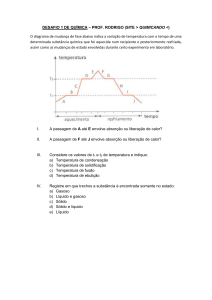
Lista de Exercício de Química -
No 4
Profa. Marcia Margarete Meier
1) Indique o tipo de ligação química que ocorre entre os seguintes compostos no estado
sólido: a) CaCO3; b) Pt; c) ZrO2 (ponto de fusão 2.677oC); d) benzeno; e) I2.
2) A ligação covalente ocorre tanto em sólidos moleculares (exemplo diamante) quanto
em sólidos covalentes (exemplo sacarose). Por que esses dois tipos de sólidos diferem
tanto quanto a dureza e pontos de fusão?
3) Uma substância branca funde-se a 730oC. Como um sólido é um não-condutor de
eletricidade, mas dissolve-se em água para formar uma solução condutora. Que tipo
de sólido pode ser esta substância?
4) Qual tipo de força atrativa intermolecular atua entre a) todas as moléculas; b)
moléculas polares; c) o átomo de hidrogênio de uma ligação polar e um átomo vizinho
pequeno e eletronegativo (F, O, N)?
5) O etilenoglicol (HOCH2CH2OH), a principal substância em anticongelantes, tem ponto
de ebulição em 199oC. Em contrapartida, o álcool etílico (CH3CH2OH) entra em
ebulição a 78 oC a pressão atmosférica. O éter dimetílico etilenoglicol
(CH3OCH2CH2OCH3) tem ponto de ebulição em 83 oC, e o éter etil-metil (CH3CH2OCH3)
tem ponto de ebulição normal de 11 oC.
Considerando as forças intermoleculares, responda:
a) Explique por que a substituição de um hidrogênio no oxigênio por CH3 geralmente
resulta em um ponto de ebulição mais baixo.
b) Quais são os fatores mais importantes responsáveis pela diferença nos pontos de
ebulição dos dois éteres?
6) Os elementos xenônio e ouro têm ambos estruturas no estado sólido que consistem
em arranjos de empacotamento densos cúbicos de átomos. Mesmo assim, Xe se funde
a -112oC e ouro se funde a 1.064 oC. Esclareça essa enorme diferença nos pontos de
fusão considerando as forças intermoleculares e as ligações químicas nestes
compostos.
7) Apesar da água pura ser mau condutor de eletricidade, é aconselhável não se operar
aparelhos elétricos perto dela. Por quê?
8) Quando o metanol, CH3OH, é dissolvido em água, obtém-se uma solução não
condutora. Quando o ácido acético CH3COOH, dissolve-se em água, a solução é má
condutora e de natureza ácida. Descreva o que acontece na dissolução nos dois casos
e julgue as diferenças.
9) Descreva a equação de ionização ou dissociação das substâncias abaixo em água:
a)ZnCl2; b) HNO3; c) K2SO4; d) Ca(OH)2. Quais delas formam soluções salinas, ácida ou
básica?
10) Qual é a diferença entre: a) ácido monoprótico e ácido diprótico; b) ácido fraco e forte;
c) ácido e base? Dê um exemplo de cada uma destas espécies.
11) Ao medirmos a condutividade de uma solução contendo 1 mol/L de HCl(aq) e na
seqüência medirmos a condutividade de uma solução contendo 1 mol/L de ácido
acético, qual das duas deverá apresentar maior valor de condutividade?
1