Alcinos
Alcinos
•
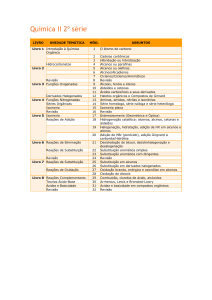
Alcinos contêm tripla ligação: a ligação sigma resulta da sobreposição de
orbitais sp-sp
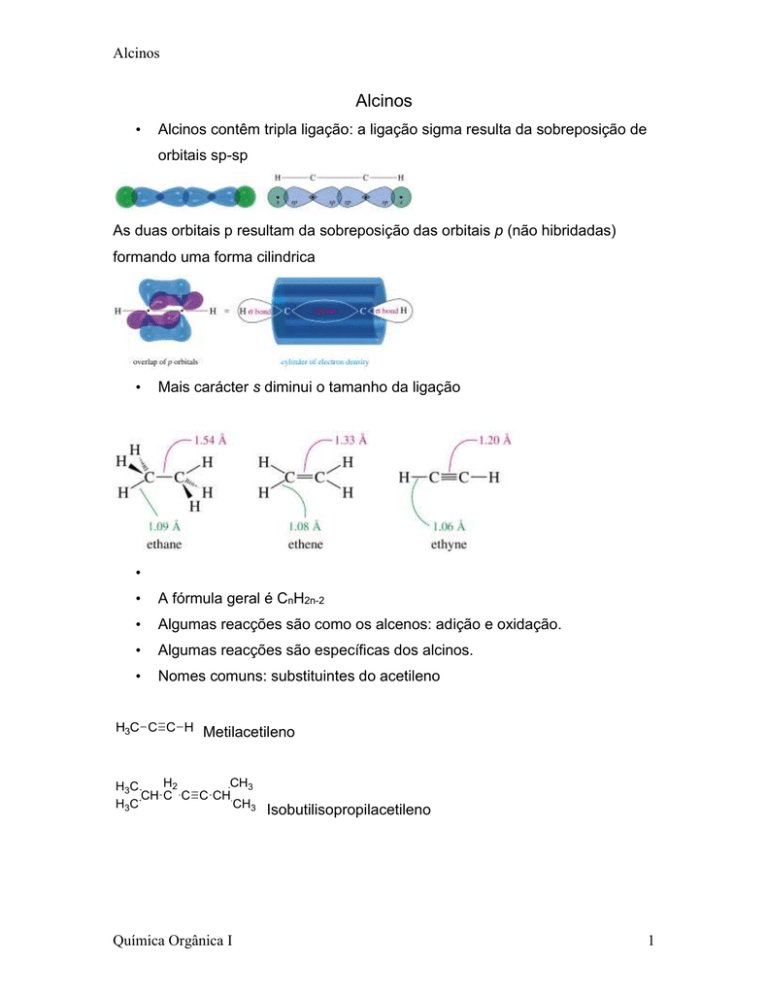
As duas orbitais p resultam da sobreposição das orbitais p (não hibridadas)
formando uma forma cilindrica
•
Mais carácter s diminui o tamanho da ligação
•
•
A fórmula geral é CnH2n-2
•
Algumas reacções são como os alcenos: adição e oxidação.
•
Algumas reacções são específicas dos alcinos.
•
Nomes comuns: substituintes do acetileno
H3C C C H Metilacetileno
H2
CH3
H3C
CH C C C CH
H3C
CH3
Química Orgânica I
Isobutilisopropilacetileno
1
Alcinos
Propriedades Físicas
•
Não polar, insolúvel em água.
•
Solúveis na maioria dos solventes orgânicos.
•
Pontos de ebulição semelhantes aos alcanos da mesma massa.
•
Menos denso que a água.
•
Acetileno, propino e butino são gases à temperatura ambiente.
•
Acidez dos alcinos:
•
Alcinos terminais, R-CC-H, são mais acidicos que outros
hidrocarbonetos.
•
Formação de iões acetilidos
1- Por reacção com a amida de sódio (NaNH2).
Não reage com o hidróxido (OH-) nem com alcóxidos (RO-).
Química Orgânica I
2
Alcinos
Quanto maior o carácter s dos electrões no anião mais perto do núcleo os
electrões se encontram. Menor separação de cargas, mais estável é o
composto.
Os iões acetilenos são nucleófilos fortes.
Um dos melhores métodos de
síntese de alcinos é o ataque nucleofílico pelo ião acetileno a um haleto de
alquilo não impedido estereamente.
2- Por reacção com metais pesados
Alcinos terminais formam precipitados com sais de prata (Ag+) e de cobre
(Cu+)
Os alcinos internos não reagem. Este facto pode ser usado para dois fins:
1- Testes qualitativos para alcinos terminais;
2- Separação de alcinos terminais de alcinos internos.
Síntese de alcinos
1- apartir de acetilidos
2- por eliminação
1- Síntese de alcinos a partir de acetilidos
1.a- Reacção com haletos de alquilo
Química Orgânica I
3
Alcinos
Os aniões acetilidos são bons nucleófilos pelo podem reagir com haletos de
alquilo por mecanismo SN2. O halogénio é então substituído formando-se o
acetileno.
Se o substrato for impedido estereamente pode formar-se o produto da
eliminação E2.
1.b- Adição ao grupo carbonilo
Da reacção do ião acetilido com o grupo carbonilo forma-se um alcinol (um
alcool em que o carbono adjacente tem uma ligação tripla).
Mecanismo da reacção
Química Orgânica I
4
Alcinos
2- Síntese de alcinos por eliminação
•
Da remoção de duas moléculas de HX a partir de um dihaleto vicinal e
geminal forma-se um alcino.
•
Primeiro passo forma-se o (-HX) e o haleto de vinilo.
•
O segundo passo existe a remoção do HX do haleto vicinalpor uma base
forte a elevada temperatura. É o passo lento da reacção.
Os reagentes usados no segundo passo da reacção podem ser de dois tipos:
a) KOH fundido ou KOH em solução alcoolica a 200 ºC num tubo fechado;
b) Amida de sódio a 150ºC e depois água.
Dada a presença de base forte pode ocorrer rearranjo do alcino depois de
formado. Ocorre uma isomerização.
Química Orgânica I
5
Alcinos
a tripla ligação migra ao longo da cadeia carbonada por repetida desprotonação
e protonação.
Reactividade dos alcinos
•
Semelhante aos alcenos
•
Uma ligação pi dá origem a duas sigma.
•
Normalmente exotérmica
•
Uma ou duas moléculas são adicionadas.
Adição de hidrogénio ao alceno
Pode ocorrer por três reacções:
1. Adição de grande quantidade de H2 com um metal como catalisador (Pd,
Pt, ou Ni) de forma a reduzir o alcino a alceno e a alcano.
2. Usar um catalisador especial, o catalisador de Lindlar de modo a
converter o alcino em cis-alceno.
3. Reagir o alcino com sódio em amónia líquida de modo a formar o transalceno.
1- Hidrogenação catalítica
2- Redução do alcino com catalisador de Lindlar
Química Orgânica I
6
Alcinos
•
O catalisador de Lindlar é paládio envenenado composto por sulfato de
bário coberto por paládio envenenado com quinolina.
•
Ocorre a adição “sin” do H2, formando-se o cis-alceno
Uma alternativa ao uso deste catalisador é o uso de Ni 2B com o qual o
rendimento da reacção apresentação superior.
3- Redução do alcino com Na em amónia liquida
•
Usar CO2 sólido de modo a manter a amónia líquida.
•
O sódio sólido dissolve-se na amónia perdendo um electrão.
•
O electrão é solvatado pela amónia formando uma solução azul escura.
NH3
+ Na
Química Orgânica I
NH3 e
-
+
+ Na
7
Alcinos
Mecanismo da reacção
Adição de halogénios
•
Cl2 e Br2 adicionam-se aos alcinos formando dihaletos de vinil
•
A adição pode ser “sin” ou “anti”, pelo que os produtos são isómeros cis e
trans
•
É difícil parar a reacção no dihaleto.
Química Orgânica I
8
Alcinos
Se duas moles de halogénio são adicionadas ao alcino forma-se o tetrahaletos.
Adição de haletos de hidrogénio
•
HCl, HBr, e HI adicionam aos alcinos formando haletos de vinilo.
•
Em caso de alcinos terminais, os produtos formados são de orientação
Markovnikov
•
Se são adicionadas duas moles de HX o produto é um dihaleto geminal
No caso da presença de peroxidos a adição de HBr segue a orientação antiMarkovnikov.
Química Orgânica I
9
Alcinos
Hidratação de alcinos
•
Sulfato de mercurio em solução aquosa de ácido sulfúrico adiciona H-OH
a uma ligação pi com orientação Markovnikov, formando um álcool vinilico
(enol) que rearranja originando uma cetona.
•
A oxidação por hidroboração adiciona H-OH com orientação antiMarkovnikov e rearranja formando um aldeído
Mecanismo de reacção de mercuriação
•
Ião mercúrio é o electrófilo (Hg2+)
•
O carbocatião vinilo forma-se no carbono mais substituido.
•
A água é o nucleófilo
Química Orgânica I
10
Alcinos
A passagem do enol a ceto em meio ácido: chama-se o tautomerismo cetoenólico.
Em solução acidica o tautomerismo ceto-enólico tem lugar por adição do protão
ao átomo de carbono adjacente, seguido da perda do protão do hidroxilo.
Oxidação por hidroboração
É adicionado um reagente muito impedido, disiamilborano, ao carbno menos
impedido da tripla ligação. Este reagente é usado para impedir a adição de duas
moléculas de borano ao alcino.
Química Orgânica I
11
Alcinos
A oxidação do vinilborano (usando um peroxido de hidrogénio básico) forma
álcool vinilico (enol) como resultado da adição de água à tripla ligação. A
orientação é anti-Markovnikov.
Oxidação de alcinos
•
Semelhante à oxidação de alcenos
•
Uma solução de KMnO4 diluída, neutra oxida os alcinos a dicetonas
•
Uma solução KMnO4 básica a quente provoca a quebra da tripla ligação.
•
Ozonolise seguida de hidrólise quebra a tripla ligação.
Reacção com o permanganato
Se um alcino for tratado com permanganto de potássio aquoso perto da
neutralidade
o resultado é a formação de uma -dicetona. Ocorre uma
hidroxilação das ligações pi do alcino e posteriormente a perda de duas
moléculas de água formando uma dicetona.
Se a mistura de reacção ficar demasiado quente ou se tornar básica a dicetona
quebra-se oxidativamente. Os produtos são sais de ácido carboxílico, que se
podem converter em ácidos livres adicionando ácido diluido.
Química Orgânica I
12