FQE0001
Universidade do Estado de Santa Catarina – UDESC
Centro de Ciências Tecnológicas – CCT
Departamento de Química - DQM
Físico-Química Experimental
Exp. 03
Volume Parcial Molar
1. Introdução
As variáveis termodinâmicas podem ser classificadas em dois tipos: propriedades
intensivas (independentes da quantidade de material) ou extensivas (proporcionais à
quantidade de material em questão). Pressão (p) e temperatura (T) são exemplos de
propriedades intensivas, enquanto volume (V), entalpia (H), energia livre de Gibbs (G) são
exemplos de propriedades extensivas.
Entre as propriedades intensivas importantes na termodinâmica, encontramos as
quantidades parciais molares, definidas por:
onde Q pode ser qualquer propriedade extensiva já mencionada.
Para um sistema formado por um único componente, as quantidades parciais molares
são idênticas às quantidades molares,
. Para soluções ideais de gases ou líquidos,
algumas quantidades parciais molares (Vi, Ei, Hi) são iguais às respectivas quantidades
molares dos componentes puros, enquanto outras (Si, Ai, Gi) não. Para soluções não-ideais,
todas as quantidades parciais molares diferem da correspondente quantidade molar.
A propriedade parcial molar mais fácil de visualizar é o volume parcial molar,
definido como a contribuição que um componente de uma mistura faz para o volume total da
mistura. Por exemplo, devido às interações moleculares, a medida do volume total resultante
da mistura de dois líquidos reais (ex.: etanol e água) desvia-se do volume total calculado a
partir dos volumes adicionados de cada espécie. No caso da mistura etanol / água, por
exemplo, ocorre uma contração de volume.
A definição formal do volume parcial molar, , de uma substância i em uma
determinada composição, é:
onde o índice n´ significa que o número de mols de todas as outras substâncias presentes são
constantes. Assim, o volume parcial molar é o coeficiente angular da curva do volume total da
mistura em função do número de mols de i, quando a pressão, temperatura e o número de
mols dos demais componentes da mistura forem constantes.
Em uma mistura ideal, o volume (V) da mistura dos componentes i e j independe do
tamanho do sistema, e pode ser determinado se a composição (xA e xB) e o volume molar dos
componentes puros ( e ) são conhecidos. A expressão que descreve estes parâmetros é
descrita na equação a seguir e representa a característica de misturas ideais, ou seja, misturas
onde as interações moleculares são desprezíveis:
onde V é o volume (mL) e o volume molar médio (mL/mol).
Esta equação, entretanto, perde a validade quando misturas reais estão envolvidas (ex.:
etanol/água). Para estes casos os volumes reais da mistura desviam dos valores ideais devido à
contração de volume que ocorre na mistura.
FQE0001
Universidade do Estado de Santa Catarina – UDESC
Centro de Ciências Tecnológicas – CCT
Departamento de Química - DQM
Físico-Química Experimental
Exp. 03
Neste caso, os volumes reais podem ser calculados através dos volumes parciais
molares dos componentes da mistura ( e ). A diferença entre os volumes molares real e
ideal define a variação média de volume molar da mistura ( ).
A dependência da composição em ( ) é dada pôr:
Assim, de acordo com as equações adequadas para ( e ), os volumes parciais
molares do etanol (i) e da água (j), para composições específicas (xi e xj) são obtidos através
dos valores medidos de (V), conhecidos os volumes molares das substâncias puras.
Para determinar o volume parcial ocupado por um mol do componente i ou j numa
determinada concentração de uma mistura binária é necessário conhecer a variação do V total
ou de com relação à composição da solução naquela concentração (isto é, V = f (ni, nj) ou
a T e p constantes).
Os dados de vs. xj são tratados numericamente por qualquer método de ajuste de
dados (isto é, da determinação dos parâmetros e da forma de uma função que melhor se ajuste
aos dados experimentais). Uma vez encontrada a função, o coeficiente angular pode ser
calculado em qualquer ponto, por simples derivação.
Por exemplo, para uma função do tipo:
(equação de uma reta):
; coeficiente angular do gráfico
vs. xj.
E pode-se aplicar as equações:
Traçando-se vs. xj e aplicando-se as equações acima para determinar e , pode-se
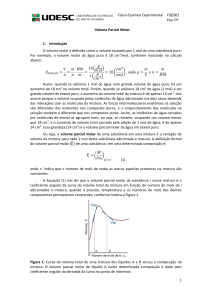
determinar os volumes parciais molares de i e j em qualquer concentração (Figura 1).
Vm
Va
Vb
0,0
0,2
0,4
0,6
0,8
1,0
Xb, fração molar do compoente B
Figura 1: Exemplo genérico mostrando uma relação linear entre
e xb.
FQE0001
Universidade do Estado de Santa Catarina – UDESC
Centro de Ciências Tecnológicas – CCT
Departamento de Química - DQM
Físico-Química Experimental
Exp. 03
2. Objetivos
Medir o volume real (V)e a variação do volume molar (V), de misturas formadas
com diferentes composições de etanol e água.
Calcular o volume parcial molar ( ) de cada componente das misturas, para as
composições selecionadas, comparando-os com os volumes molares das substâncias puras.
Utilizando uma mistura adequada, investigar a confiabilidade da determinação do
volume parcial molar através da comparação dos volumes calculados destas misturas com os
volumes medidos.
3. Procedimento Experimental
3.1 - Materiais utilizados
Água destilada
Etanol
8 Balões volumétricos de 100 mL
Balança
Pipeta
Proveta de 100 mL
3.2 - Procedimento
Pesar os balões, anotando sua massa na Tabela 1.
Adicionar volumes de água destilada, conforme especificado na Tabela 1.
Pesar novamente os balões.
Adicionar etanol aos balões e antes de chegar até ao menisco, feche os balões e agiteos vigorosamente. Deixe-os repousando durante 10 min.
Complete os balões com etanol até o menisco. Agite-os novamente.
Pese os balões.
Com os dados experimentais determinar o volume molar da mistura não ideal e a
variação média de volume da mistura (V) em função da fração molar.
Tabela 1: Dados obtidos nas medidas de volume para misturas de água e etanol.
Balão
Massa
Volume de
mb + massa
mb + ma +
balão (mb) água (mL)*
água (ma)
massa etanol
1
0
2
10
3
20
4
40
5
50
6
60
7
80
8
100
*Observe que este volume depende do volume total do balão!
FQE0001
Universidade do Estado de Santa Catarina – UDESC
Centro de Ciências Tecnológicas – CCT
Departamento de Química - DQM
Físico-Química Experimental
Exp. 03
4. Discussão dos Resultados
A partir das massas dos dois componentes, pode-se calcular a fração molar, a
densidade e o volume molar. Lembre-se que as densidades dos componentes podem ser
obtidas a partir das massas e volumes dos balões das soluções puras de etanol e água.
Faça um gráfico de
vs. xetanol, obtenha o coeficiente angular da reta, aplique as
equações adequadas e determine os volumes parciais molares da água e etanol.
Determinar os volumes parciais molares de cada componente da mistura através da
curva obtida para a variação de volume em função da composição. Faça um gráfico
sobrepondo os valores dos volumes molares parciais com o gráfico anterior.
5. Questões
1. Calcule o volume real da solução para uma determinada composição e compare com
o valor experimental. (Os volumes molares das substâncias puras à 20oC são 58,277 mL/mol
para o etanol e 18,073 mL/mol para a água)
2. Com os volumes parciais molares encontrados no experimento, determine o volume
real de uma solução formada por 2,0 L de etanol e 1,5 L de água.
6. Referências Bibliográficas
1. Atkins, P; de Paula, J.; Físico-Química. Vols. 1-2. Nona Edição. Rio de Janeiro:LTC.
2012.
2. Rangel, R. N. Práticas de Físico-Química. 3. ed. São Paulo:Edgard Blücher, 2006.
3. Smith, J.M.; van Ness, H.C.; Introdução à Termodinâmica da Engenharia Química. 3ª
Edição. Rio de Janeiro: Ed. Guanabara Dois, 1980.
4. Shoemaker, D. P.; Garland, C. W.; Nibler, J. W. Experiments in Physical Chemistry.
Fifth Edition. New York:McGraw-Hill, 1989.