UNIVERSIDADE FEDERAL DE UBERLÂNDIA
4ª Semana do Servidor e 5ª Semana Acadêmica
2008 – UFU 30 anos
DOENÇA DE CHAGAS E SUA IMPLICAÇÃO NA MORFOLOGIA DO
CORAÇÃO
Mileide Maria de Assunção Sousa¹; Karina do Valle Marques, Walter Rade e Rogério
Facury².
Universidade Federal de Uberlândia (Campus Umuarama) – Uberlândia-MG, Brasil.
Resumo: Este artigo propõe-se a fazer um estudo da Doença de Chagas e suas alterações na
morfologia do coração, abordando, através de uma revisão bibliográfica, a anatomia do coraçao,
as causas, formas de contaminação, as manifestações e possíveis conseqüências da Doença de
Chagas. Pode-se perceber que tal doença se manifesta de diferentes formas e que, dentre as
diversas alterações que provoca na morfologia cardíaca, as mais presentes são aumento de
volume, miocárdio amolecido e apresentando formato irregular.
Palavras chave: Trypanossoma cruzi, miocárdio, cardiomegalia.
1 INTRODUÇÃO
1.1 Doença de Chagas
A Doença de Chagas é uma zoonose de natureza endêmica e de evolução crônica. Apresenta
ampla distribuição geográfica nas Américas, estendendo-se desde o centro-oeste mexicano até o
extremo sul do Chile e da Argentina.8 Estima-se que sejam de 16 a 18 milhões os indivíduos
infectados e de aproximadamente 80 milhões a população em risco de contaminação na América
Latina.9
O causador da Doença de chagas é um tripanossomo (espécie Trypanosoma cruzi),
protozoário mastigóforo encontrado nas formas flagelada e aflagelada. No hospedeiro vertebrado
(mamífero), a forma flagelada é observada no sangue, enquanto a forma aflagelada produz
grupamentos chamados ninhos, no interior das células como as do coração e do sistema nervoso,
particularmente as células nervosas do esôfago e do intestino. Em seu ciclo vital, o tripanossomo
passa por hospedeiros diferentes (o barbeiro e o mamífero); por isso, é considerado um parasita
heteroxênico.3
1.1.1 Modos de transmissão:
Transmissão pelo vetor: esta é a principal via de aquisição de infecções pelo T. cruzi, e é
considerada como responsável pela endemicidade da doença de Chagas na América Latina.4
As principais espécies transmissoras do tripanossomo são Triatoma infestans, Rhodnius
prolixus e Panstrongylus megistus, insetos da ordem Hemíptera conhecidos vulgarmente como
barbeiros, que são hematófagos e têm hábitos noturnos. (figura 1)
¹- Acadêmica do curso de Medicina. ² - Orientadores.
1
Figura 1 – um barbeiro adulto (que deve seu nome ao fato de picar preferencialmente o rosto, durante o sono do
hospedeiro) defeca próximo ao local da picada, enquanto se alimenta.
O barbeiro infecta-se com o tripanossomo e passa a ser um transmissor quando suga o
sangue de vertebrados silvestres (como a cutia, o gambá e o tatu) e de animais domésticos (como o
cão e o gato), que são reservatórios naturais do parasita. Faz seus ninhos em frestas nas paredes de
casas de pau-a-pique (figura 2) e pode também se alojar em colchões, atrás de móveis, em paióis e
galinheiros, alimentando-se do sangue das aves.
Figura 2 – casa de pau-a-pique, moradia ideal para barbeiros.
A ação hematófaga do barbeiro sobre seres humanos e animais domesticados deve-se
sobretudo à ocorrência de desmatamentos, que o levaram a mudar o habitat e a dieta.3
É fácil perceber que as distorções econômicas influenciam fortemente a distribuição social
da parasitose, na medida em que ocorre deficiências na qualidade de vida do homem interiorano.
Historicamente, em toda a América Latina, essa qualidade já se acha profundamente comprometida,
especialmente em relação às condições de moradia (que interessam no caso particular da
domiciliação dos triatomíneos), mas também no que concerne à saúde e à educação, perpetuando
inexoráveis ciclos de pobreza/enfermidade.9
Quando pica uma pessoa ou animal infectados, o barbeiro ingere tripanossomos com o
sangue. Estes se multiplicam por divisões binárias no tubo digestivo do inseto, assumindo a forma
flagelada infectante no final do intestino. Ao picar uma pessoa e defecar, o barbeiro elimina os
parasitas com as fezes. Pelo orifício da picada, por lesões provocadas pela coçagem, ou mesmo
através de mucosas íntegras, os tripanossomos penetram no corpo, invadem células e multiplicamse, chegando finalmente à corrente sangüínea, por meio da qual atingem vários órgãos.
Nas células desses órgãos, os tripanossomos convertem-se na forma aflagelada e dividem-se,
originando novas formas flageladas, que rompem as célula e retornam à corrente sangüínea.
Alcançam outros órgãos e formam em suas células novos ninhos da forma aflagelada. O ciclo
repete-se continuamente, afetando principalmente o coração, o sistema nervoso e o sistema
digestivo do infectado.3
Transmissão por transfusão de sangue: comprovada nos anos 50, a transmissão
transfusional do T. cruzi foi considerada problema grave de saúde publica entre nós, estimando-se
que, ao inicio da década de 80, cerca de 20 mil novos caos de doença de Chagas transfusional
(DCT) eram produzidos anualmente no Brasil.3 É considerada a segunda via mais freqüente de
contaminação.8
Hoje os riscos de transmissão da DCT no Brasil são mínimos, tendo sido estimados entre
três e vinte ocorrências no contexto de mais de 4 milhões de transfusões anuais.3
Transmissão transplacentária e pelo leite: a transmissão transplacentária do T. curzi para
o concepto é causa importante de aborto, natimorto e prematuridade, naquelas regiões onde a
2
doença de Chagas é endêmica. A freqüência com que as mães chagásicas transmitem o T. cruzi para
os filhos varia de 0,1 a 2,58%. A importância da transmissão congênita na epidemiologia da doença
de Chagas é difícil de avaliar devido à pobreza de investigações nesta área. Entretanto, a profilaxia
das infecções do T. cruzi pelo vetor e por transfusão de sangue levará finalmente a maior interesse
por esta forma de transmissão.
Transmissão pelo leite tem sido observada em mulheres e em animais de experimentação
com a infecção aguda. Existe um caso publicado em que a jovem mãe com a doença de Chagas
aguda tinha o T. cruzi no colostro antes e depois da parturição, mas o recém-nato não adquiriu a
infecção congenitamente. Foi recomendado suspender o aleitamento materno. Por outro lado, se
tem observado que as infecções por T. cruzi são exacerbadas durante a gestação, quando as
parasitemias podem voltar a patência, provavelmente como resultado da depressão da imunidade
celular que acompanha a gravidez.8
Transmissão acidental: ocorre em laboratórios ou hospitais, quando da manipulação
inadequada de material contaminado por pessoas susceptíveis. Exemplos: manejos de triatomíneos,
de culturas, de animais de experimentação infectados, manejo de sangue da pacientes com forma
aguda. Pelo menos 60 casos já foram registrados.
Transmissão oral: ocorre pela ingestão de alimentos contaminados pelo parasito, sendo
usual entre mamíferos do ciclo silvestre da tripanossomíase, que ingerem triatomíneos ou outros
mamíferos infectados. Para o homem, há relatos esparsos de sua ocorrência, um deles no Rio
Grande do Sul, outro na Paraíba e outro no México, além de casos prováveis na Amazônia
brasileira. 9
1.2 O coração
O coração é um órgão muscular oco que é de certo modo piramidal no formato e se situa
dentro do pericárdio, no mediastino. Ele está conectado na sua base aos grandes vasos sanguíneos,
mas situa-se livremente dentro do pericárdio.
As paredes do coração são compostas de uma lâmina espessa de músculo cardíaco, o
miocárdio, coberta externamente pelo epicárdio e revestida internamente pelo endocárdio. A porção
atrial do coração possui paredes relativamente finas e é dividida pelo septo atrial em átrios direito e
esquerdo. A porção ventricular do coração possui paredes espessas e é dividida pelo septo
interventricular em ventrículos direito e esquerdo.
O chamado esqueleto do coração consiste em anéis fibrosos que circundam os óstios
atrioventriculares, do tronco pulmonar e da aorta e são contínuos à parte membranácea superior do
septo interventricular. Os anéis fibrosos em torno dos óstios atrioventriculares separam as paredes
musculares dos átrios daquelas dos ventrículos, mas fornecem inserção para as fibras musculares.
Os anéis fibrosos suportam as bases das cúspides e impedem as valvas de se estenderem e se
tornarem incompetentes.
1.2.1 Câmaras do coração
Átrio direito: O átrio direito é constituído de uma cavidade principal e de uma pequena
evaginação, a aurícula. Do lado de fora do coração, na junção entre o átrio direito e a aurícula
direita, existe um sulco vertical, o sulco terminal, que do lado de dentro forma uma crista, a crista
terminal. 7
A superfície interna das paredes posterior e medial do átrio direito é lisa, enquanto as
superfícies da parede lateral e da aurícula direita são compostas de feixes musculares paralelos, os
músculos pectíneos.6
A veia cava superior se abre na parte superior do átrio direito e não possui válvula. A veia
cava inferior (maior que a superior) se abre na parte inferior do átrio direito; ela é guardada por uma
válvula rudimentar e sem função.
3
O seio coronário, que drena a maior parte do sangue da parede do coração se abre no átrio
direito entre a veia cava inferior e o óstio atrioventricular ; ele é guardado por uma válvula
rudimentar e sem função.
O óstio atrioventricular direito se situa anterior ao óstio da veia cava inferior e é guardado
pela valva atrioventricular direita (tricúspide).
Há também muitos orifícios pequenos das pequenas veias que drenam a parede do coração e
se abrem diretamente no átrio direito.
Além da válvula rudimentar da veia cava inferior, existem a fosso oval e o limbo da fossa
oval. Estas ultimas estruturas se situam no septo atrial que separa o átrio direito do átrio esquerdo.
A fossa oval no feto. O limbo da fossa oval forma a margem superior da fossa. O assoalho da fossa
representa o persistente septum primum do coração do embrião, e o limbo é formado da margem
inferior do septum secundum.
Ventrículo direito: o ventrículo direito se comunica com o átrio direito através do óstio
atrioventricular, e com o tronco pulmonar através do óstio do tronco pulmonar. À medida que a
cavidade se aproxima do óstio do tronco pulmonar, ela toma a forma de um funil e, neste ponto, é
chamada infundíbulo.
As paredes do ventrículo direito são muito mais espessas do que aquelas do átrio direito e
apresentam diversas cristas internas projetantes formadas de feixe de músculo. As cristas
projetantes dão à parede do ventrículo uma aparência esponjosa e são conhecidas como trabéculas
cárneas. As trabéculas cárneas são compostas de três tipos. O primeiro tipo compreende os
músculos papilares, que se projetam para dentro, sendo ligados por suas bases à parede do
ventrículo; seus ápices estão conectados por cordões fibrosos (as cordas tendíneas) às cúspides da
valva atrioventricular direita. As do segundo tipo estão presas nas suas extremidades à parede do
ventrículo, sendo livres no meio. Uma destas, a trabécula septomarginal (faixa moderadora), cruza a
cavidade do ventrículo, do septo ate a parede anterior. Ela conduz o ramo direito do fascículo
atrioventricular, que é parte do sistema condutor do coração. O terceiro tipo é simplesmente
composto de cristas proeminentes.
A valva atrioventicular direita guarda o óstio atrioventricular. Ela consiste em três cúspides
formadas por uma prega de endocárdio com um pouco de tecido conjuntivo incluído. As cúspides
são anterior, septal e posterior. As bases das cúspides estão inseridas no anel fibroso do esqueleto
do coração enquanto suas margens livres e faces ventriculares estão presas nas cordas tendíneas. As
cordas tendíneas conectam as cúspides aos músculos papilares. Quando o ventrículo se contrai, os
músculos papilares se contraem e impedem que as cúspides sejam forçadas para dentro do átrio e
viradas ao avesso à medida que a pressão intraventricular aumenta. Para auxiliar neste processo, as
cordas tendineas de um músculo papilar são conectadas às partes adjacentes de suas cúspides.
A valva do tronco pulmonar guarda o óstio do tronco pulmonar. Ela consiste em três
cúspides semilunares formadas por pregas de endocárdio com um pouco de tecido conectivo
incluído. Não existem cordas ou músculos papilares associados a estas cúspides; as conexões dos
lados das cúspides com a parede da artéria impedem as cúspides de fazerem prolapso pra o interior
do ventrículo. Na raiz do tronco pulmonar estão três dilatações chamadas seios, e um está situado
externamente a cada cúspide.
As três válvulas semilunares estão dispostas como uma cúspide posterior e duas anteriores.
Durante a sístole ventricular, as cúspides de cada válvula são pressionadas contra a parede do tronco
pulmonar pela saída precipitada do sangue. Durante a diástole, o sangue flui para trás em direção ao
coração e penetra nos seios; as cúspides das valvas se enchem, entram em aposição no centro do
lúmen e fecham o óstio do tronco pulmonar.
Átrio esquerdo: semelhante ao átrio direito, o átrio esquerdo consiste em uma cavidade
principal e em uma aurícula esquerda. O átrio esquerdo esta situado atrás do átrio direito e forma a
maior parte da base ou face posterior do coração. Atrás dele fica o seio obliquo do pericárdio
seroso, e o pericárdio fibroso o separa do esôfago.7
4
O endocárdio do átrio esquerdo é liso ligeiramente opaco. Os músculos pectineos ocorrem
apenas na aurícula esquerda, que se projeta do átrio esquerdo anterolateral, ao longo da artéria
pulmonar. O septo interatrial é liso, mas pode conter uma área central superficial, que corresponde à
fossa oval.
O átrio esquerdo recebe o sangue das veias pulmonares (duas de cada lado)7 e serve de
reservatório, durante a sístole ventricular esquerda, e de condutor, durante o enchimento ventricular
esquerdo. Além disso, a contração atrial esquerda proporciona um aumento significativo do sangue
para o ventrículo esquerdo, expandindo o ventrículo e preparando-o para a ejeção ventricular.6
Ventrículo esquerdo: o ventrículo esquerdo se comunica com o átrio esquerdo através do
óstio atrioventricular e com a aorta através do óstio da aorta. As paredes do ventrículo esquerdo são
três vezes mais espessas do que as do ventrículo direito. (A tensão sangüínea intraventricular
esquerda é seis vezes mais alta do que aquela no interior do ventrículo direito.) Em corte
transversal, o ventrículo esquerdo é circular; o direito é semilunar por causa da protuberância do
septo interventricular dentro da cavidade do ventrículo direito. Há trabéculas cárneas bem
desenvolvidas, dois grandes músculos papilares, mas não existe trabécula septomarginal.
A valva atrioventricular esquerda (mitral) guarda o óstio atrioventricular. Ela consiste em
uma cúspide anterior e uma posterior, que possuem uma estrutura semelhante aquela das cúspides
da valva atrioventricular direita. A inserção das cordas tendíneas nas cúspides e músculos papilares
é semelhante àquela da valva atrioventricular direita.
A valva da aorta guarda o óstio da aorta.
1.2.2 Sistema condutor do coração
O coração normal se contrai ritmicamente por volta de 70 a 90 batimentos por minuto no
adulto em repouso. O processo contração rítmico se origina espontaneamente no sistema condutor e
o impulso viaja a regiões diferentes do coração, de modo que os átrios se contraem primeiro e
juntos, para serem seguidos mais tarde pelas contrações em conjunto de ambos os ventrículos. A
ligeira demora na passagem do impulso dos átrios para os ventrículos da tempo para os átrios
esvaziarem seu sangue nos ventrículos antes que estes se contraiam.
O sistema condutor do coração é constituído de músculo cardíaco especializado presente no
nó sinoatrial, nó atrioventricular, fascículo atrioventricular e nos seus ramos terminais direito e
esquerdo, e no plexo subendocárdico das fibras de Purkinje. O nó sinoatrial é o local onde é iniciada
a contração do músculo do coração e é freqüentemente chamado marcapasso.
O sistema condutor do coração é responsável não apenas pela geração de impulsos cardíacos
rítmicos, mas também pela condução destes impulsos rapidamente por todo o miocárdio do coração,
de modo que as diferentes câmaras se contraiam de uma maneira coordenada e eficiente.
1.2.3 Suprimento arterial do coração
O suprimento arterial do coração é fornecido pelas artérias coronárias direita e esquerda, que
se originam da aorta imediatamente acima da valva da aorta. (figura 3) Elas e seus ramos principais
são distribuídos sobre a superfície do coração alojando-se dentro do tecido conectivo subepicárdico.
Figura 3 - Esquema suprimento arterial do coração
5
Embora ocorram anastomoses entre os ramos terminais das artérias coronárias, elas não são
grandes o suficiente para fornecer um suprimento sangüíneo adequado para o músculo cardíaco se
um dos grandes ramos se tornar bloqueado por doença.
1.2.4 Drenagem venosa do coração
A maior parte do sangue da parede do coração drena para o átrio direito através do seio
coronário. Este se situa na parte posterior do sulco atrioventricular e é uma continuação da veia
cardíaca magna. Ele se abre no átrio direito à esquerda da veia cava inferior. A veia cardíaca parva e
a veia cardíaca media são tributárias do seio coronário. O restante do sangue é retornado para o átrio
direito pela veia cardíaca anterior e também por pequenas veias que se abrem diretamente nas
câmaras do coração.
1.2.5 Suprimento nervoso do coração
O coração é inervado pelas fibras simpáticas da parte autônoma do sistema nervoso via
plexos cardíacos situados abaixo do arco da aorta. O suprimento simpático origina-se das porções
torácicas superior e cervical, e o suprimento parassimpático origina-se do nervo vago.
As fibras simpáticas pós-ganglionares terminam nos nós sinoatrial e atrioventricular, nas
fibras do músculo cardíaco e nas artérias coronárias. Sua ativação resulta na aceleração dos
batimentos cardíacos, no aumento da força de contração do miocárdio e na dilatação das coronárias.
As fibras parassimpáticas pós-ganglionares terminam nos nós sinoatrial e atrioventricular e
nas artérias coronárias. Sua ativação resulta na redução da freqüência e força de contração do
coração e na constrição das artérias coronárias.
As fibras aferentes que correm os nervos simpáticos transportam impulsos nervosos que
normalmente não alcançam a consciência. Entretanto, se o suprimento sangüíneo para o miocárdio
torna-se prejudicado, impulsos de dor alcançam a consciência através deste caminho. As fibras
aferentes que correm com o nervo vago participam nos reflexos cardiovasculares.7
O objetivo do estudo apresentado é conhecer melhor a doença de Chagas e as alterações
morfológicas no coração devido à doença.
2 MÉTODOS
O presente trabalho foi feito através de revisão bibliográfica de artigos científicos e livros.
3 RESULTADOS E CONCLUSÃO
Com base na leitura e na revisão bibliográfica realizada pode-se concluir que a doença de
Chagas pode se apresentar sob as seguintes formas: forma indeterminada, caracterizada pela
ausência de sintomas e sinais significativos de comprometimento orgânico; na forma digestiva,
secundária a lesão do plexo mioentérico, que gera incoordenação motora e, em casos avançados,
dilatação do órgão acometido (megas); e forma cardíaca, considerada a mais freqüente em nosso
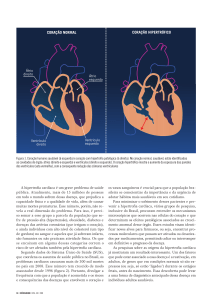
meio. (Figura 4)
Figura 4 - Radiografia mostrando o aumento do volume do coração chagásico (cardiomegalia).
6
3.1 Forma Aguda
A forma aguda da doença de Chagas representa, na realidade, uma infecção generalizada
pelo T. cruzi. As formas amastigotas podem ser encontradas nas secções histólogicas de quase todos
os órgãos e no interior de vários tipos celulares, usualmente acompanhadas por um infiltrado
mononuclear, congestão aguda e edema. As células parasitadas incluem fibras musculares lisas,
esqueléticas e cardíacas, fibroblastos, macrófagos, células gliais, células endoteliais, células de
Schwann e neurônios. Os parasitos intracelulares por vezes são abundantes na chamada “gordura
cinzenta”, e havia dúvida se as células parasitadas eram mesmo adipócitos. Os órgãos parasitados
vão desde aqueles onde o encontro de parasitos é registrado como raridade, como o ovário, testículo
e tireóide, até os músculos liso, estriado esquelético e cardíaco, onde as lesões são comuns e muito
mais proeminentes, e o sistema nervoso central. Devido à baixa mortalidade de forma aguda e à sua
ocorrência predominantemente rural, são relativamente poucos os estudos publicados sobre a
anatomia patológica dessa forma da doença de Chagas no homem. Depois do extenso programa de
profilaxia que vem sendo feito nos últimos anos, não só no Brasil como nos paises do Cone Sul, a
forma aguda da doença de Chagas de origem vetorial tornou-se realmente uma raridade. O interesse
pela sua patologia todavia persiste devido à possibilidade do aparecimento eventual de casos por
transmissão congênita, acidentes de laboratório, por ingestão de alimentos contaminados e póstransfusionais. As formas de reativação vistas em portadores de imunodeficiências aparecem hoje
com muita freqüência.
Os portadores da forma aguda podem vir a falecer de insuficiência cardíaca (miocardite), de
meningoencefalite ou de complicações, como a broncopneumonia.
A miocardite é a lesão mais constante e é muito intensa, mesmo naqueles pacientes que, em
vida, mostram apenas sinais escassos de envolvimento cardíaco ou que, nas necrópsias, mostram
corações sem alterações macroscópicas evidentes. Os que falecem em insuficiência cardíaca
mostram um coração flácido, congesto, moderadamente aumentado de volume, mais por dilatação
que por hipertrofia, e com petéquias ou sufusões hemorrágicas, subepicárdicas e subendocárdicas.
As tromboses intracárdicas são excepcionais. Na emergência dos grandes vasos pode ser encontrado
um linfonodo aumentado de volume, representando um processo de linfoadenite inespecífica. As
formas amastigotas poderão ser encontradas no interior desse linfonodo. Ele representa um centro
de drenagem dos linfáticos cardíacos. Estes formam dois troncos – um direito e outro esquerdo –
que drenam a linfa miocárdica através de uma rede subepicárdica que acompanha os vasos
coronarianos, anastomosando-se e convergindo para a base do coração. Assim, o aumento de
volume do linfonodo, que passa do diâmetro de alguns milímetros para 0,5 a 2 cm, representa um
reflexo das alterações inflamatórias em curso no miocárdio. Daí, embora não seja patognomônica, a
sua presença tem valor para o diagnostico da miocardite chagásica, inclusive na forma crônica
cardíaca, onde ele também pode aparecer.
Ao exame microscópico do coração, vêem-se intenso infiltrado mononuclear e edema,
dissociando as fibras cardíacas, as quais podem exibir graus diversos de alterações regressivas. Os
parasitos são facilmente encontrados. Em um paciente tratado durante 5 dias e que veio a falecer, os
parasitos foram muito escassos nas lesões, embora a reação inflamatória fosse de grande
intensidade. É possível que a destruição das formas intracelulares dos parasitos contribua para
exacerbar a reação inflamatória.
Tal demonstração foi feita a principio experimentalmente, levando ao uso clínico de tal
esquema terapêutico em dois pacientes com a forma aguda da doença, com total sucesso. O
infiltrado inflamatório envolve todas as estruturas do coração e estende-se ao endo- e pericárdio,
onde podem ocorrer densos acúmulos focais. Envolve os nervos, o sistema excitocondutor e os
gânglios parassimpáticos da parede atrial. Estes podem mostrar sensível diminuição do número dos
neurônios. Também a base das válvulas cardíacas pode ser infiltrada pelas células mononucleares,
onde predominam os linfócitos.
Em material experimental, o estudo ultra-estrutural demonstra que as células inflamatórias
são predominantemente pequenos linfócitos, grandes linfócitos granulares de núcleo chanfrado
7
(células NK), macrófagos e plasmócitos. Os linfócitos e macrófagos podem aparecer aderidos, com
fusão de membrana ao sarcolema dos miocardiocitos. Nesses pontos de contato, e por vezes em
quase toda a miocélula, ocorrem tumefação e rotura de mitocôndrias, dilatação de retículo
endoplasmático e dissolução de miofibrilas, com rotura e fragmentação dos discos intercalares.
As lesões da microvasculatura miocárdica foram a principio descritas como resultantes de
agregação plaquetária na infecção do camundongo. Sugeriu-se que o inicio do processo seria uma
ação direta do T. cruzi ao se colonizar no interior de células endoteliais. Essa possibilidade parece
remota, uma vez que tal parasitismo é excepcional, mesmo em infecções com elevadas cargas
parasitárias. Ao exame ultra-estrutural da miocardite chagástica aguda no modelo canino, os
capilares miocárdicos mostram tumefação endotelial, agregação plaquetaria e trombos fibrinosos.
Por vezes essas lesões são coincidentes com a presença de linfócitos na luz do capilar, com forte
aderência membranar à célula endotelial. Ocorre, portanto, uma microangiopatia na miocardite
aguda chagástica, provavelmente iniciada com a agressão citotóxica ao endotélio por células
imunologicamente competentes.
O sinal de Romanã e o chagoma têm o mesmo significado de uma lesão de porta de entrada.
O seu aparecimento em 10 a 15 dias após a inoculação e a sua duração de 30 a 60 dias sugerem uma
reação de hipersensibilidade mediada por células. As alterações histológicas encontradas em
material experimental e humano limitam-se a descrever uma reação proliferativa com fibroblastos,
macrófagos e células endoteliais, além de congestão e edema e a presença de parasitos no
citoplasma de macrófagos. Na pele (chagona) foram descritas lesões eritematosas
(esquizotripânides) e nódulos cutâneos, que representam focos de paniculites e de reações
granulomatosas, com ou sem parasitos (chagomas metastáticos).
3.2 Forma Latente ou Indetermianda
Um dos aspectos mais enigmáticos da doença de Chagas diz respeito ao que acontece
durante o longo período (geralmente cerca de 5-10 anos ou mais) entre as manifestações da fase
aguda e o aparecimento das manifestações da forma crônica cardíaca ou digestiva.
Em indivíduos infectados, mas aparentemente assintomáticos, que vieram a falecer
subitamente, acidentalmente ou por outras causas que não a doença de Chagas, vários autores têm
registrado a presença de uma miocardite focal discreta e, pricipalmente, redução do número de
neurônios nos plexos nervosos parassimpáticos do coração e do tubo digestivo.
Muitos desses casos não podem ser enquadrados na definição de forma indeterminada
dentro do critério da Sociedade Brasileira de Medicina Tropical, por não terem tido estudo
eletrocardiográfico prévio. Esse fato é importante, pois um estudo feito em chagásicos
assintomáticos acometidos de morte súbita, tido como pertencentes à forma indeterminada, revelou,
nas necrópsias, que todos já exibiam as características anátomo-patológicas da forma crônica
cardíaca da doença de Chagas. Alguns pesquisadores têm recorrido às biópsias endomiocárdicas
para os seus estudos. Há aqui os problemas com os erros de amostragem, pois as lesões têm uma
distribuição focal. Em um desses estudos, apenas 15% das biópsias mostraram discretas reações
inflamatórias, enquanto 85% apareceram histologicamente normais. Já em outro estudo, 61% das
amostras mostraram discretos infiltrados inflamatórios, alterações degenerativas e inespecíficas das
fibras miocárdicas, edema intersticial e fibrose. A correlação tem sido feita entre o encontro das
lesões mais acentuadas e a probabilidade de o indivíduo vir a desenvolver a forma cardíaca
progressiva. Este último dado levanta uma suspeita difícil de ser afastada, isto é, se a forma cardíaca
já não estaria, em tais casos, nos sues primeiros estágios de desenvolvimento.
Embora essa forma da doença de chagas tenha sido bem definida, a sua patogenia é pouco
conhecida. O substrato anatômico é representado pelas lesões inflamatórias microscópicas focais,
no seio das quais os parasitos são raramente demonstrados pelos métodos histológicos comuns.
Todavia, técnicas imunoistoquímicas têm possibilitado a comprovação de material antigênico do T.
cruzi nessas lesões na ausência de parasitos demonstrados histologicamente. Também, quando
foram aplicadas técnicas de hibridização in situ, foi possível revelar traços do genoma do parasito
8
nas lesões focais miocárdicas. Esses achados são fortemente sugestivos de que as lesões focais
encontradas no coração em portadores da forma indeterminada são parasito-dependentes. Todavia,
o significado das lesões miocárdicas focais tem sido discutido, pois para uns elas seriam
cumulativas e, com o tempo, resultariam no comprometimento difuso (confluente) do miocárdio,
inclusive com fibrose disseminada, enquanto para outros elas representariam um estado de
equilíbrio parasito-hospedeiro. Há ainda outros que sugerem, com base em estudos experimentais,
uma lesão microvascular, provocada por fatores imunes, com ação continua e cumulativa. A
resposta a essas perguntas parece muito difícil de ser dada em estudos com material humano. Em
camundongos com infecção prolongada, e que se apresentavam aparentemente sadios, foram
encontradas lesões evolutivas de arteriolite necrotizante, além de lesões inflamatórias focais,
sobretudo no coração e nos músculos esqueléticos. Nesses animais não se pode dizer que tenha
ocorrido um equilíbrio biológico hospedeiro-parasito, mas sim o estabelecimento de uma doença
progressiva de baixa intensidade, com parasitos persistentemente presentes nas lesões.
Com base no que foi aqui descrito, os focos inflamatórias que aparecem como que inibidas
no seu potencial agressivo, mas que se acumulam no tecido intersticial acompanhadas por um cento
grau de fibrose. Após um lapso de tempo, as células inflamatórias são removidas por apoptose,
enquanto o excesso de matriz sofre degradação. Com base nesses dados ultra-estruturais, as lesões
da miocardite focal da forma indeterminada foram interpretadas como sujeitas a um ciclo evolutivo,
autolimitado, equilibrado pelo aparecimento de umas lesões e desaparecimento de outras, o que
permitiria longa sobrevida do hospedeiro.
3.3 Forma Crônica Cardíaca
Essa forma é caracterizada pela presença de uma miocardiopatia inflamatória de tipo
dilatada, fibrosante, de evolução protraída e fatal, que cursa com insuficiência cardíaca congestiva
ou morte súbita, fenômenos tromboembólicos, arritmias variadas. Tem sido discutido se haveria
duas formas de apresentação da doença: uma prodominantemente arrítmica, que levaria à morte
súbita e que apresentaria um coração de tamanho ainda dentro dos limites da normalidade, com
comprometimento particularmente grave do sistema de condução do coração; enquanto a outra seria
do tipo congestivo, com cardiomegalia, trombose intracardíaca e infartos em vários órgãos. Até
diferenças mais freqüentes nos indivíduos que faleceram subitamente. A outra diz respeito à
linfoadenomegalia que aparece na emergência dos grandes vasos e que representa uma linfoadenite
satélite da miocardite chagásica. Lopes e cols. Encontraram tal linfonodo em aproximadamente
75% dos chagásicos que tiveram morte súbita, e em 40% dos que apresentaram insuficiência
cardíaca congestiva. Na realidade, a morte súbita pode acometer portadores da forma crônica
cardíaca da doença em qualquer fase da sua evolução. Tambemos achados anatomo-patologicos não
diferem essencialmente entre os indivíduos que morrem subitamente e aqueles com longa historia
de insuficiência cardíaca congestica. Do ponto de vista histológico, não é possível separar os dois
grupos, mesmo quando o sistema de condução é examinado.9
Portadores de cardiomiopatia chagásica crônica apresentam um padrão especifico de
variação circadiana na freqüência de eventos de taquicardia ventricular. Esse padrão, caracterizado
por um pico pronunciado entre meio-dia e 18:00h e um nadir noturno, indica que o padrão
circadiano pode diferir do padrão.8
3.4 Dados gerais
A descrição que se segue refere-se aos achados cardíacos e, eventualmente extracardíacos,
obervados nas necrópsias de indivíduos que vieram a falecer após progressiva insuficiência cardíaca
congestiva.
3.4.1 Aspectos macroscópicos
9
O coração fica aumentado de volume e assume uma forma arredondada, globóide, com a
ponta formada pelos dois ventrículos e com os vasos venosos congestos fazendo um proeminente
desenho vascular na superfície epicárdica que é habitualmente lisa, transparente e brilhante. Podem
ser notadas áreas focais esbranquiçadas e planas de espessamento epicárdico, relativamente
freqüentes na face ântero-superior do órgão (“manchas lácteas”). Ao longo das artérias coronárias,
ficam escalonados grumos esbranquiçados, formando um pontilhado que tem sido comparado a um
“rosário”. Microscopicamente, esses grumos contêm uma composição laminar acelular de fibras
colágenas e, provavelmente, representam uma variação das “manchas lácteas”. Alguns patologistas
chegaram a considerar esse “rosário” coronariano como patognomônico da miocardite crônica
chagásica, mas, embora a lesão seja mais freqüente e nítida nessa condição, também aparece em
cardiomegalias de outras etiologias, até mesmo nas não inflamatórias.
O miocárdio fica amolecido, embora não esteja flácido, e mostra espessura irregular com
áreas de afinamento que se alternam com zonas hipertrofiadas, o que pode ser mais bem apreciado
quando o órgão é transiluminado, como ao se ascender uma lâmpada no interior da cavidade
ventricular. Esse aspecto talvez tenha um grande significado, pois estudos de medicina nuclear têm
revelado áreas miocárdicas de hipocontratilidade e de baixa perfusão coronariana, provavelmente
decorrentes de alterações da inervação autonômica ou de destruições focais de fibras dos sistema de
condução. Em ambos os casos, poder-se-iam formar áreas com distúrbios de despolarização que
seriam comprimidas e distendidas em cada sístole ventricular, assim sofrendo gradativa atrofia. Ao
ser seccionado, o miocárdio mostra uma fina e difusa fibrose, mas bem apreciada em secções
longitudinais ao longo do septo interventricular. Por vezes, esse septo mostra de espessura muito
reduzida. As alterações já referidas podem contribuir para explicar a insuficiência cardíaca
predominantemente direita dos chagásicos, pois a integridade do septo é fundamental para manter a
força de ejeção da câmara ventricular direita. Outras áreas mostram-se com nítida hipertrofia, por
vezes alcançando 2cm de espessura. As câmaras cardíacas mostram nítido grau de dilatação,
sobretudos as direitas, todas contendo muito sangue e coágulos cruóricos e lardáceos.9
Além das observações já feitas, observou-se em um estudo realizado que pacientes com
doença de Chagas sem cardiopatia aparente apresentam alteração precoce dos ventrículos direito e
esquerdo.5
3.5 Referências bibliográficas
1.
Abello, M., Zuelgaray, J., Daglio, M., Lopez, C., Garraza, S., Szyszko, A. Padrão
Circadiano dos Episódios de taquicardia ventricular em portadores de cardiopatia chagásica.
Sociedade Brasileira de Cardiologia, p. 240-242;
2.
Brener, Zigman., Andrade, A., Barral-Netto, M., Trypanossoma Cruzi e Dpença de Chagas.
2ª edição Editora Guanabara Koogan.
3.
Dias, J. Doença de Chagas e transfusão de sangue no Brasil: vigilância e desafios. Revista
Brasileira hematologia e hemoterapia, p. 83-84, 2006;
4.
Martin Gurgel, C., Almeida, E. Freqüência da hipertensão arterial em chagásicos crônicos e
sua repercussão no coração: estudo clínico e anatomopatológico.
5.
Pinto, A., Oliveira, B., Botoni, F., Ribeiro, A., Rocha, M. Disfunção Miocárdia em Pacientes
Chagásicos sem Cardiopatia Aparente, Sociedade Brasileira de Cardiologia, p. 385-390.
6.
Silverman, M.D. e Shlant, M.D. Anatomia do Sistema Cardiovascular normal In: O
Coração. 4ª edição, p. 19-26;
7.
Snell, R. O tórax: parte II, a cavidade do Tórax. In:___Anatomia Clínica para estudantes de
medicina. 5ª ed, p. 90-96, Editora Guanabara Koogan;
8.
Teixeira, A. Modos de transmissão. In:___Doença de chagas e outras doenças causadas por
tripanossomos. P.19-20;
9.
Vinhaes, M., Pinto Dias, J. Doença de Chagas no Brasil. Caderno de Saúde Pública, Rio de
Janeiro, 2000;
10