Síntese do acetilacetonato de ferro(III)
Realização experimental a microescala
(protocolo de Szafran, Pike & Foster1)
Introdução
A reacção entre o cloreto de ferro(III) e a acetilacetona permite obter o
acetilacetonato de ferro(III). A reacção pode representar-se pela equação química (1),
onde Hacac representa a acetilacetona. A equação química (2) representa o efeito
tampão da solução de acetato de sódio.
Fe3+(aq) + 3Cl-(aq)+ 3(Hacac)(l) Fe(acac)3(s) + 3H+(aq)+3Cl-(aq)
(1)
CH3COO- + H3O+ CH3COOH + H2O
(2)
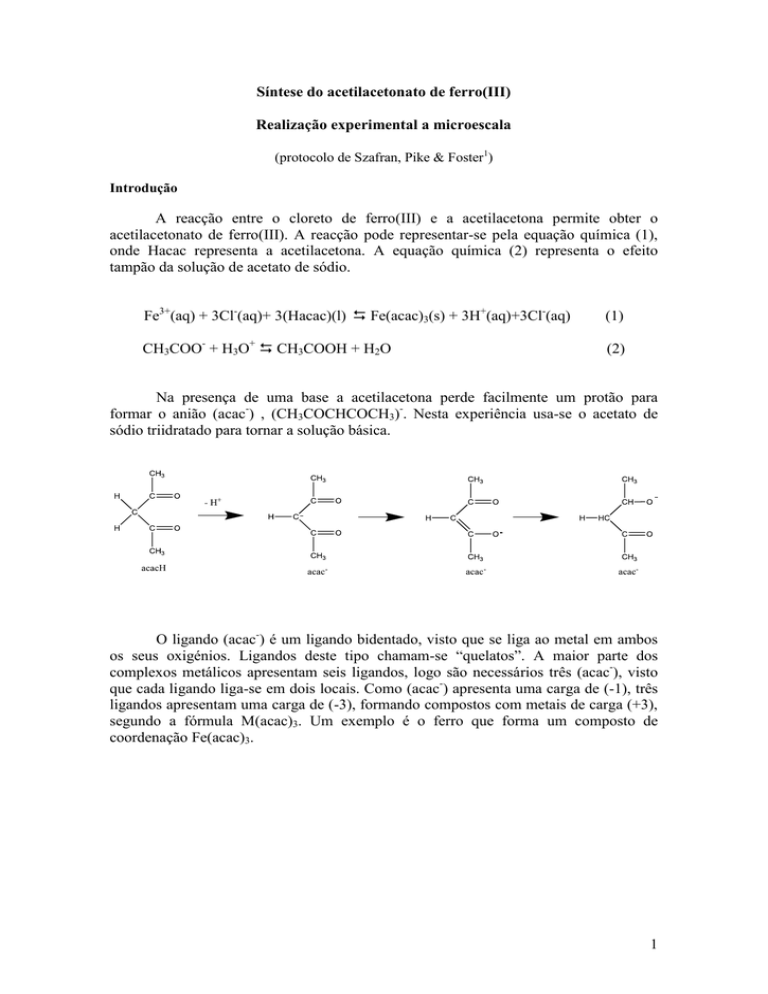
Na presença de uma base a acetilacetona perde facilmente um protão para
formar o anião (acac-) , (CH3COCHCOCH3)-. Nesta experiência usa-se o acetato de
sódio triidratado para tornar a solução básica.
O ligando (acac-) é um ligando bidentado, visto que se liga ao metal em ambos
os seus oxigénios. Ligandos deste tipo chamam-se “quelatos”. A maior parte dos
complexos metálicos apresentam seis ligandos, logo são necessários três (acac-), visto
que cada ligando liga-se em dois locais. Como (acac-) apresenta uma carga de (-1), três
ligandos apresentam uma carga de (-3), formando compostos com metais de carga (+3),
segundo a fórmula M(acac)3. Um exemplo é o ferro que forma um composto de
coordenação Fe(acac)3.
1
Como a parte exterior do complexo consiste em grupos orgânicos, este
composto é hidrofóbico e insolúvel na água, logo o produto precipita da solução.
2
Procedimento experimental
1. Num copo de 10 mL, colocar cerca de 280 mg de cloreto de ferro(III) hexaidratado.
Anotar rigorosamente a massa de reagente usada.
Fig 1 – Cloreto de ferro(III) hexaidratado
2. Colocar o copo num agitador magnético e adicionar 5 mL de água desionizada e uma
barra magnética. Agitar até o tricloreto de ferro se dissolver completamente.
Fig 2 – Solução aquosa de cloreto
de ferro(III) hexaidratado
3. Num copo de 5 mL dissolver 500 mg de acetato de sódio triidratado em 2,5 mL de
água. Juntar esta solução à solução de cloreto de ferro(III), mantendo a agitação.
Fig 3 – Mistura da solução aquosa de cloreto de
ferro(III) com a solução aquosa de acetato de sódio
3
4. Com uma pipeta automática adicionar, na HOTTE, 500 μL de acetilacetona. Agitar
durante cerca de 10 minutos à temperatura ambiente. Formam-se cristais vermelhos
brilhantes de acetilacetonato de ferro(III).
Fig 4 – Junção da acetilacetona
Fig 5 –Formação do precipitado de
tris(acetilacetonato) de ferro(III)
5. Após cristalização mexer bem, filtrar os cristais por sucção, com um funil de Buchner
ou de Hirch. Lavar com 2 mL de água.
Fig 6 – Filtação
Fig 7 – Poduto no filtro para secagem
4
6. Deixar os cristais secar num excicador, mantendo o papel de filtro.
Fig 8 – Produto no excicador
7. Depois de seco, retirar o produto do papel de filtro e pesar.
Fig 9 –Produto final seco
Bibliografia:
1. Szafran, Pike & Foster, “Microscale General Chemistry Laboratory with Selected Macroscale
Experiments”, exp.28, p365-371
5
Síntese de acetilacetonato de ferro(III)
Reagentes estequiométricos:
- cloreto de ferro(III) hexaidratado (CAS No. 10025-77-1)
MM (FeCl3.6H2O) – 270,2952
280mg – 1,04 mmol
- acetilacetona (CAS 123-54-6)
MM (C5H8O2) – 100,117
D= 0,975
500 μL – 4,87 mmol
cerca de 55% de excesso
Substâncias auxiliares
Solventes
- água desionizada
Outras substâncias auxiliares
- acetato de sódio triidratado (CAS No. 6131-90-4)
MM (C2H9NaO5) – 136,07987
500mg – 3,64 mmol
Produto (CAS 14024-18-1)
- acetilacetonato de ferro(III) - (C5H7O2)3Fe
MM ((C5H7O2)3Fe) – 353,1723
Resíduos:
- cloreto de sódio em solução aquosa
- acetilacetona em excesso
- ácido acético diluído
- acetato de sódio em solução aquosa
Material
Copo 10mL
Copo de 5 mL
Erlenmeyer de 10 mL
Proveta de 10mL
Pipeta de Pasteur
Caixas de Petri de 40 mm
Vidro de relógio de 40 mm
Barra magnética
Espátula
Vareta de vidro
Funil de Buchner, diam. 27 mm
Cone Guko de borracha
Papel de filtro de filtração lenta
Material para filtração por vácuo, com 2 Kitasatos de 100 mL
Saca barras magnéticas
Equipamento
Balança analítica ou semi-analítica
Placa de aquecimento com agitação
6












