Clapeyron
CALOR é uma forma de energia em transito
de um ponto a outro do espaço.
TRANSFERÊNCIA DE CALOR
CONDUÇÃO
CONVECÇÃO
RADIAÇÃO
Alterar a temperatura
Alterar a temperatura
Alterar o estado físico
Alterar a temperatura
Calor
SENSÍVEL: Altera a
temperatura do corpo
LATENTE: NÃO altera a
temperatura do corpo
Quantidade de Calor (Q)
É a medida da energia
térmica transferida de um
corpo para outro.
•Usualmente medida em CALORIAS
•No SI é medida em Joules
1 cal = 4,18 J
A variação na temperatura de um
corpo depende de:
• Quantidade de calor recebida (Q);
• Do material que constitui o corpo (c);
• Massa do corpo (m);
Q
T
m
Quantidade de Calor (Q)
trocada entre dois ou mais corpos
Q = m.c.T
Onde
Q é a quantidade de calor recebido (Q>0) ou cedido (Q<0);
m é a massa do material;
T é a variação de temperatura;
c é o CALOR ESPECÍFICO DA SUBSTÂNCIA.
Num determinado estado físico
Quantidade de Calor (Q)
Q = m.c.T
Que macete!
Unidade do calor específico
Q = m.c.T
como
Q
c
,
m.T
cal J
ou, então
no SI [c][c]
g.Kg
C .K
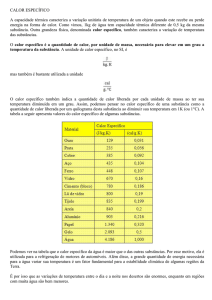
substância em cal/g oC substância
em cal/g oC
água
1,00
gelo
0,50
alumínio
0,22
latão
0,094
areia
0,20
mercúrio
0,033
cobre
0,093
ouro
0,032
chumbo
0,031
prata
0,056
estanho
0,055
vapor de água
0,48
ferro
0,11
vidro
0,20
éter
0,56
álcool
0,58
acetona
0,52
concreto
0,20
etanol
0,59
metanol
0,61
silício
0,17
titânio
0,054
POTÊNCIA Térmica
Potência térmica (pot) ou Fluxo de
calor () é a medida da velocidade
com a qual o calor se propaga
Q
pot t
Para um objeto...
Q
C
Q C . T
T
C
Q
T
cal
C
o
Para um objeto...
MAIÚSCULO
Capacidade Térmica (C)
Q = m.c.T
c é o calor específico característico do
material (elemento ou substância).
Sistema Térmicamente Isolado
Sistema Térmicamente Isolado
Para isolar o sistema utiliza-se um
CALORÍMETRO
Calorímetro é um aparelho utilizado em
laboratório com o objetivo de minimizar
as trocas de calor com o meio externo.
Q
C
m.c
T
Cobertura
METÁLICA
Dizemos que o
calorímetro
ideal é aquele
que tem
CAPACIDADE
TÉRMICA
desprezível
(próxima a
zero!)
lição
ESTADOS FÍSICOS DA MATÉRIA
SÓLIDO
LÍQUIDO
PLASMA
GASOSO
Estado da Matéria
Table 9
propriedade
Sólido
Liquido
Gás (Vapor)
i)
FORMA
definida
indefinida
indefinida
ii)
VOLUME
definido
definido
indefinido
iii)
Interação
Molecular
iv)
Exemplos
Muito forte.
Forte.
Moléculas
fixas
Moléculas
ligadas.
fraca
NaCl
ZnSO4
H2O
Petróleo
H2 , CO2
Ar
Plasma, é um gás ionizado constituído de elétrons
livres, íons e átomos neutros, em proporções variadas.
☼ Principalmente nas estrelas (altas Temperaturas);
☼ Também a “baixas temperaturas” (sob ação de
campos eletromagnéticos).
Calor
SENSÍVEL: Altera a
temperatura do corpo
LATENTE: NÃO altera a
temperatura do corpo
MUDANÇAS DE ESTADO
Dependem:
• pressão ambiente (p)
• Temperatura do material (T)
MUDANÇAS DE ESTADO
• Para uma dada pressão, cada
substância apresenta um
ponto de fusão/solidificação e
outro de ebulição/evaporação.
MUDANÇAS DE ESTADO
Se a pressão for constante,
então as temperaturas
também serão constantes
durante a mudança de fase.
T (oC)
CALOR
LATENTE
CALOR LATENTE
LÍQUIDO + VAPOR
CALOR
SENSÍVEL
CALOR SENSÍVEL
SÓLIDO + LÍQUIDO
Q(cal)
CALOR SENSÍVEL
QUANTIDADE DE
CALOR SENSÍVEL
Q=m.C.T
QUANTIDADE DE
CALOR LATENTE
A quantidade de calor latente que um
objeto qualquer deve receber (ceder)
para mudar de estado físico depende:
Da massa do objeto (m);
Do material do qual o objeto é feito (L)
Q=m.L
onde L é o calor latente do material.
Que = MaLa!
Q=m.L
Q
L
m
Q
L
m
Q
L
m
cal
L
g
Qual a energia necessária para
transformar 10g de gelo a -20oC
em vapor d’água, a 110oC ?
Esquentando
o gelo
Derretendo o
gelo
Esquentando
a água
Fervendo a
água
Esquentando
o vapor
d’água
Q1=m.c.T
Q1 = 10.0,5.20
Q1 = 100cal
Q2 = m.L
Q2 = 10.80
Q2 = 800cal
Q3 = m.c.T
Q3 = 10.1.100
Q3 = 1000cal
Q4 = m.L
Q4 = 10.540
Q4 = 5400cal
Q5 = m.c.T
Q5 =
10.0,48.10
Q5 = 48cal
LÍQUIDO + VAPOR
T (oC)
SÓLIDO + LÍQUIDO
Q(cal)