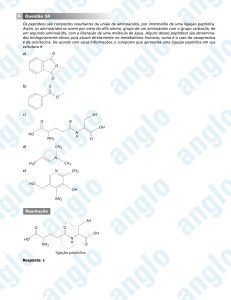
Aminas
Introdução
Derivados orgânicos da amónia
Muitos são biológicamente activos.
Classes de aminas
Primárias (1): uma ligação C-N, 2 ligações N-H.
Secundárias (2): duas ligações C-N, 1 ligação N-H.
Tertiárias (3): três ligações C-N, nenhuma ligação NH.
Quaternária (4): quatro ligações C-N, azoto tem uma
carga formal positiva.
Nomes IUPAC
Nome é baseado na cadeia de carbono mais comprida.
-a do alcano é substituido por -amina.
Substituintes no azoto têm o prefixo N-.
Br
N(CH3)2
NH2CH2CH2CHCH2CH3
CH3CH2CHCH2CH2CH3
3-bromo-1-pentanamina
N,N-dimethyl-3-hexanamina
Aminas Aromaticas
Grupo amina está ligado ao anel de benzeno.
O composto mais familiar é a anilina
NH2
CH3
NH2
N
CH3
H3C
anilina
N,N-dimetilanilina
4-metilanilina
ou p-toluidina
Estrutura das Aminas
Azoto tem uma hibridação sp3 com o par de electrões
não partilhado em uma orbital sp3.
Pontos de ebulição
N-H é menos polar que o O-H.
Forma ligações de hidrogénio mais fracas.
Aminas terciárias não formam ligações de hidrogénio.
Solubilidade e cheiro
Aminas pequenas (<6 C) solúveis em água.
Todas as aminas aceitam ligações de hidrogénio do
álcool e da água.
Basicidade de aminas
O par de electrões não partilhado pode aceitar o protão
do ácido
Soluções aquosas são básicas.
Amónia pKb = 4.74
Aminas alquilicas são normalmente bases mais fortes
que amónia.
Diagrama de energia
Grupos alquilo são dadores de electrões e desestabilizam o
catião.
Efeitos de ressonância
Qualquer deslocalização do par de electrões enfraquece
a base.
Efeitos de hibridação
Electrões são mais fortemente seguros em orbitais com
mais caracter s portanto esses compostos são bases
mais fracas.
Alquilação de Amines
Aminas reagem com haletos de alquilo 1 via mecanismo
de SN2.
Misturas de produtos mono-, di-, e tri-alquilados são
obtidos.
Alquilações úteis
Alquilação exaustiva para formar sais de tetralquilamónio.
NH2
CH3CH2CHCH2CH2CH3
3 CH3I
NaHCO3
_
+
N(CH3)3 I
CH3CH2CHCH2CH2CH3
• Reacção com elevado excesso de NH3 para formar uma
amina primária.
CH3CH2CH2Br
NH3 (xs)
CH3CH2CH2NH2 + NH4Br
Eliminação de Hofmann
Sais de amónio quaternário têm um bom grupo
abandonante - a amina neutra.
Aquecer o sal de amónio produz o alceno menos
substituído.
+
N(CH3)3
_
I
CH3CHCH2CH2CH3
Ag2O
H2O
_
+
N(CH3)3 OH
CH3CHCH2CH2CH3
heat
CH2 CHCH2CH2CH3
E2 Mecanismo
Sintese de Arilaminas 1°
A maioria é sintetizada por nitração do anel aromático a
que se segue redução catalitica do grupo nitro a grupo
amina.
COOH
COOH
+ 3 H2
NO2
3-N itroben zoic
acid
Ni
(3 atm)
+ 2 H2 O
NH2
3-Aminobenzoic
acid
Reagente ácido nitroso
Ácido nitroso é produzido in situ misturando nitrito de
sódio com HCl.
O ácido nitroso é protonado, perde água para formar
o ião nitrosonium.
+
H O N O
H
H
H O N O
+
+
H2O + N O
+
N O
Reacção com ácido nitroso
Tratando a amina primária aromática com HNO2 forma-se o
sal de diazonium.
NH2 + NaNO2 + HCl
Anilin e
(a 1° aromatic
amin e)
Sodium
n itrite
H2 O
0°C
+
N N Cl + H2 O
Ben zenediazoniu m
chloride
Aquecendo a solução aquosa forma-se o fenol e o gas, N2.
+
N N Cl + H2 O
Ben zenediazoniu m
chloride
OH + N2
Ph enol
Fim