Exercícios sobre eletroquimica 2 ano
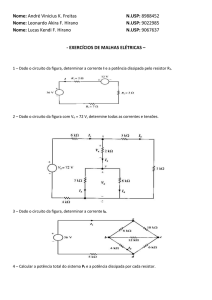
Exercício 1: (PUC-RIO 2008)
O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida
quando se une uma meia-pilha onde a reação eletrolítica de redução ocorre espontaneamente (catodo)
com outra meia pilha onde a reação eletrolítica de oxidação, ocorre espontaneamente (anodo).
Com base nas semi-reações eletrolíticas acima, colocadas no sentido da oxidação, e seus respectivos
potenciais, assinale a opção que indica os metais que produzirão maior valor de ddp quando combinados
para formar uma pilha.
A)
Cobre como catodo e prata como anodo.
B)
Prata como catodo e zinco como anodo.
C)
Zinco como catodo e cádmio como anodo.
D)
Cádmio como catodo e cobre como anodo.
E)
Ferro como catodo e zinco como anodo.
Exercício 2: (PUC-RIO 2008)
Considere o esquema abaixo que representa uma pilha constituída de metal cobre em solução aquosa de
sulfato de cobre e metal cádmio em solução de sulfato de cádmio.
Uma tabela fornece a informação de que os potenciais padrões de redução do Cu2+ e do Cd2+ são,
respectivamente, +0,34 V e -0,40 V e que a prata é um elemento mais nobre que o cobre. Assinale a
opção que mostra a ordem decrescente de facilidade de oxidação dos três metais citados e a diferença de
potencial (ddp) da pilha indicada na figura.
A)
Cu > Ag > Cd; -0,74 V
B)
Cd > Cu > Ag; +0,74 V
C)
Ag > Cu > Cd; -0,06 V
D)
Cd > Cu > Ag; +0,06 V
E)
Ag > Cd > Cu; -0,74 V
Exercício 3: (PUC-RIO 2007)
Considere a célula eletroquímica abaixo e os potenciais das semi-reações:
Sobre o funcionamento da pilha, e fazendo uso dos potenciais dados, é INCORRETO afirmar que:
A)
os elétrons caminham espontaneamente, pelo fio metálico, do eletrodo de níquel para o de
cobre.
B)
a ponte salina é fonte de íons para as meia-pilhas.
C)
no anodo ocorre a semi-reação Ni(s) → Ni2+(aq) + 2e
D)
no catodo ocorre a semi-reação Cu2+(aq) + 2e → Cu(s)
E)
a reação espontânea que ocorre na pilha é: Cu(s) + Ni2+(aq) → Cu2+(aq) + Ni(s)
Exercício 4: (UDESC 2010)
Uma pilha de Daniell opera em condições padrões com soluções aquosas de ZnSO 4 e CuSO4, com
diferença de potencial nos terminais de ΔE0. Cristais de CuSO4 são adicionados na respectiva solução,
alterando o potencial para ΔE, na mesma temperatura.
Pode-se afirmar que este novo potencial:
A)
permaneceu constante.
B)
aumentou.
C)
diminuiu.
D)
ficou zero.
E)
não pode ser calculado.
Exercício 5: (UDESC 2008)
Os principais fenômenos estudados pela eletroquímica são a produção de corrente elétrica, através de uma
reação
química
(pilha),
e
a
ocorrência
de
uma
reação
química, pela passagem de corrente elétrica (eletrólise). Com relação a esses fenômenos, analise as
proposições abaixo.
I – As pilhas comuns são dispositivos que aproveitam a transferência de elétrons em uma reação de
oxirredução, produzindo uma corrente elétrica, através de um condutor.
II – Em uma pilha a energia elétrica é convertida em energia química.
III – O fenômeno da eletrólise é basicamente contrário ao da pilha, pois enquanto na pilha o processo
químico é espontâneo (ΔEº > 0), o da eletrólise é não-espontâneo (ΔEº < 0).
Assinale a alternativa correta.
A)
Somente a proposição II é verdadeira.
B)
Somente as proposições I e II são verdadeiras.
C)
Somente as proposições I e III são verdadeiras.
D)
Somente a proposição I é verdadeira.
E)
Todas as proposições são verdadeiras.
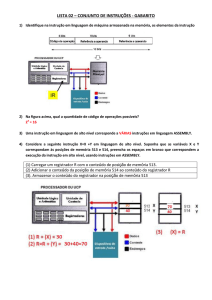
06.
a)
(PUC)
Na
pilha
oxidação
eletro-química
do
sempre
ocorre:
cátodo.
b)
c)
d)
e)
movimento
de
elétrons
no
reação
com
passagem de elétrons, no circuito
reação
interior
da
solução
eletrolítica.
diminuição
de
calor.
externo, do ânodo para o cátodo.
de
neutralização.
07. (MACK) Em uma pilha com eletrodos de zinco e de cobre, com circuito fechado, ocorre:
a) o potencial do eletrodo de zinco diminui e o do cobre aumenta;
b)
o
potencial
do
dois
eletrodos
diminui;
c) o potencial do eletrodo de zinco aumenta e o do cobre diminui;
d)
o
potencial
dos
dois
eletrodos
aumenta;
e)
o
potencial
dos
dois
eletrodos
não
se
altera.
08. (USP) Considere as seguintes semi-reações e os respectivos potenciais normais de
redução(E0):
Ni+3
+
2e¾¾®
Ni0
Au+3
+
3e¾¾®Au0
O potencial da pilha formada pela junção
a)+1,25V b)–1,25V c)+1,75V d)–1,75V e)+3,75V
E0
=
-0,25
E0
=
1,50
dessas duas semi-reações
V
V
será:
09. (MACK) A reação que ocorre em uma pilha é representada pela seguinte equação: Mn +
Cu++ ® Mn++ + Cu Sabendo-se que o potencial de óxido-redução do manganês é igual a
+1,05 volts e o do cobre é igual a –0,35 volts, e admitindo-se que a concentração dos íons é
unitária,
a
voltagem
da
pilha
será:
a)0,70volts
b)–1,40volts
c)1,40volts
d)–0,70volts
e)n.d.a.
10. (SANTA CASA) Dentre as espécies químicas representadas abaixo através de semireações:
Semi-reações
Potencial padrão de Redução (volt)
Na+ + e-
- 2,7
® Na
Cu + + e- ® Cu
+0,5
½ Cl2 + e- ® Cl-
+1,4
Qual,
nas
condições
a)Na b)Cu c)Na+ d)Cu+ e)Cl2
padrão,
11.
os
(FUVEST)
Considere
é
potenciais
a
padrões
mais
oxidante?
de
redução:
semi-reação
Ce4+
Sn4+
Qual
a)
b)
c)
d)
(em
+
+
das
Ce4+
2Ce4+
Sn4+
Ce3+
solução
1e2e-
aquosa)
reações
deve
+
Sn4+
+
Sn2+
+
Ce3+
+
Sn2+
potencial
→
Ce3+
→
®
®
®
®
Sn2+
ocorrer
Ce3+
2Ce3+
Ce4+
Ce4+
(volt)
+1,61
+0,15
espontaneamente?
+
Sn2+
+
Sn4+
+
Sn2+
+
Sn4+
12. (FUVEST) Na reação espontânea do exercício anterior, o oxidante e o redutor são,
respectivamente:
a)
Ce4+
e
Sn+2
b)
Ce4+
e
Sn4+
c)
Ce3+
e
Sn2+
d)
Sn2+
e
Ce4+
e)
n.d.a.
13. (PUC) Conhecendo-se as seguintes equações de meia-célula e os respectivos potenciais
padrão
do
eletrodo
(E0):
Sn++
Ag+
+
2e-
+
e-
®
®
Sn0
E0
Ag0
=
E0
-0,14
+0,80
=
volts
volts
Podemos concluir que a pilha eletroquímica que funciona segundo a reação: Sn0 + 2 Ag+ ®
Sn++ + 2 Ag0 Apresentará, nas condições padrões, a seguinte diferença de potencial:
a) 0,54volts b)0,66volts c)0,94volts d)1,46volts e)1,74volts
14. (MACK) Uma cela eletroquímica é constituída pelas semicelas Cr // Cr+3 e Ag // Ag+ cujos
valores
potenciais
E0
são:
Cr(s)
Ag
®
(s)
Quando
®
a
Cr+3(aq)
Ag+(aq)
cela
está
em
+
+
3ee-
funcionamento,
E0
E0
á
FALSA
a
=
=
+0,75
-0,80
afirmação
de
volts
volts
que:
a)
O
eletrodo,
onde
ocorre
oxidação
é
o
ânodo
da
cela.
b)
A
voltagem
da
cela
é
de
1,55
volts.
c)
O
cromo
metálico
reage
e
forma
Cr+3.
d) Os íons negativos e positivos se movimentam através da solução, mas em direções opostas.
e) Os elétrons passam através do voltímetro, da prata para o cromo.



![a) MnBr2 b) Na2S2O3 c) O3 d) [NO3]-](http://s1.studylibpt.com/store/data/004824294_1-e6644befe23aef65a5e854b9876a94db-300x300.png)