Substituição Aromática Eletrofílica:
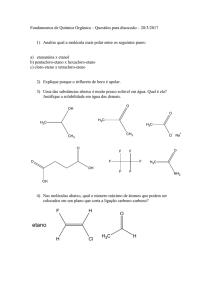
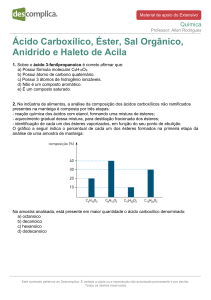
Mecanismo Geral
+
EA
d+ d-
E
E
E
H
H
H
+
+
Etapa 1 (lenta)
Íon Arênio (complexo s)
+
E
E
H
A
Etapa 2 (rápida)
+ HA
Sustituição Eletrofílica
E1
E1
E1+
E2+
E2
E1
??
E2
??
??
+
E1
E1
E1
E2
E2
orto
meta
E2
para
Grupos Ativadores – Doadores
de elétrons (Bases de Lewis)
• São todos os compostos capazes de estabilizar os
intermediários catiônicos, e podem fazê-lo por
efeito de indução ou ressonância
• Efeito de indução: Grupos alquila (CH3—)
• Efeito de ressonância: Nitrogênio e Oxigênio
ligados diretamente ao anel.
• O efeito de ressonância é mais importante
(efetivo) que o de indução
• São orto-, para- dirigentes.
Teoria dos Efeitos dos Substituintes sobre a
Substituição Aromática Eletrofílica
Efeito Indutivo
d
R
d+
R = F, Cl ou Br
O
NR3+
CX3
Ressonância
NO2
CG
G = H, R, OH ou OR
R+
R
+
E
E
H
H
NH2
NH2
OH
OR
X
Grupos Ativadores
A
+
A
A+
d A
A+
d
d
d
Grupos Desativadores –
Receptores de elétrons
(Ácidos de Lewis)
• São todos os compostos que desestabilizam
os intermediários catiônicos, e podem fazê-lo
por efeito de indução
• Todo grupo com um átomo ligado
diretamente ao anel e que possua carga
parcial positiva será um grupo desativador.
• São meta- dirigentes. Exceção ao cloro,
que é orto- e para- dirigente.
Grupos Desativadores
N
d-
d-
O
C d+
d-
O
Cd+
OH
Também ésteres,
cloretos de acila e amidas
Cd+
O
d-
O
H
N
O
Cd+
R
O
O
O
S 2+
Grupos Desativadores
D
D-
D-
D-
d D
d
d
d
Orientador vs Ativador
• O termo Orientador, refere-se à posição
relativa dos grupos em um anel Benzênico.
• O termo Ativador, refere-se ao aumento na
velocidade de reação do anel Benzênico frente
a um substituinte.
Teoria dos Efeitos dos Substituintes sobre a
Substituição Aromática Eletrofílica
Quando
benzenos
substituídos
sofrem
ataque
eletrofílico, os grupos já presentes no anel afetam tanto a
velocidade da reação, quanto o sítio de ataque. Dizemos,
portanto, que grupos substituídos afetam tanto a reatividade
como a orientação nas SAE.
Grupos Ativadores
Orientadores orto-para
Grupos Desativadores
Orientadores meta
Teoria dos Efeitos dos Substituintes
sobre a Substituição Aromática
Eletrofílica
Exemplos:
CH3
CH3
CH3
CH3
NO2
HNO3
+
H2SO4
+
NO2
Ativador
orto-para
NO2
o-nitrotolueno
59%
NO2
m-nitrotolueno
4%
NO2
HNO3
p-nitrotolueno
37%
NO2
NO2
NO2
+
H2SO4
+
NO2
Desativador
meta
NO2
o-dinitrobenzeno
6%
m-dinitrobenzeno
93%
p-dinitrobenzeno
1%
Teoria dos Efeitos dos Substituintes sobre a
Substituição Aromática Eletrofílica
Orientadores orto-para
Orientadores meta
Ativadores Fortes
Desativadores Moderados
-NH2, -NHR, -NR2, -OH, -O
-
-CN, -SO3H, -CO2H, -CO2R, -CHO,
-COR
Ativadores Moderados
Desativadores Fortes
-NHCOCH3, -NHCOR, -OCH3, -OR
-NO2, -NR3+, -CF3, -CCl3
Ativadores Fracos
-CH3, -C2H5, -R, -C6H5
Desativadores Fracos
-F, -Cl, -Br, -I
Teoria dos Efeitos dos Substituintes sobre a
Substituição Aromática Eletrofílica
Reatividade
Teoria dos Efeitos dos Substituintes sobre a
Substituição Aromática Eletrofílica
Orientação
Orientadores meta
Exemplo:
CF3
Orientadores orto-para
Exemplo:
NH2
Bibliografia
1. SOLOMONS, T.W.G.; FRYHLE, C.B. Química Orgânica. Rio de
Janeiro: LTC Editora. Vol 1, 7.ed., 2001; Vol 2, 7a ed., 2002.
(Capítulos 14 e 15).
2. VOLLHARDT, K.P.C.; SCHORE, N.E. Química Orgânica:
Estrutura e Função. Porto Alegre: Bookman. 4.ed., 2004.
(Capítulos 15 e 16).
3. BARBOSA, L.C.A. Introdução à Química Orgânica. São Paulo:
Prentice Hall. 2004. (Capítulo 5).
4. McMURRY, J. Química Orgânica. São Paulo: Pioneira Thomson
Learning. Vol 1, 2005; Vol 2, 2005. (Capítulos 15 e 16).
Compostos Carbonílicos
Compostos
Carbonílicos
O
R
R
Aldeído
R
O
O
H
Grupo
carbonílico
R'
O
HO
Cetona
R
Ácido
Carboxílico
O
R'O
Éster
Carboxilato
Nomenclatura – Aldeídos
No sistema IUPAC, os aldeídos são nomeados substitutivamente, trocandose o final -o do nome do alcano correspondente por -al.
Uma vez que o grupo aldeído está no final da cadeia carbônica, não há
necessidade de indicar sua posição. Quando outros substituintes estão
presentes, entretanto, dá-se ao C do grupo carbonílico a posição 1.
Os aldeídos, cujo grupo –CHO é ligado a um sistema cíclico, são nomeados
substitutivamente adicionando-se o sufixo carbaldeído.
O
H
O
C
H3C
H
C
CH3CH2 C
H
formaldeído
CH3
O
etanal
(acetaldeído)
CH3CHCH2 C
H
H
propanal
3-metilbutanal
O
O
C
H
O
benzenocarbaldeído
(benzaldeído)
C
cicloexanocarbaldeído
H
Nomenclatura – Cetonas
As cetonas são denominadas substitutivamente trocando-se o final -o do
nome do alcano correspondente por –ona. A cadeia carbônica é numerada
de modo que o átomo de C da carbonila tenha o menor número possível,
este numero é utilizado para designar sua posição.
Nomes comuns para cetonas são obtidos nomeando-se separadamente os
dois grupos ligados ao grupo carbonílico, adicionando-se a palavra cetona
como uma palavra separada.
O
O
CH3CCH3
CH3CCH2CH2CH3
propanona ou acetona
(dimetil cetona)
2-pentanona
(metil propil cetona)
O
O
CH3CH2CCH3
CH3CCH2CH=CH2
butanona
(etil metil cetona)
4-penten-2-ona
(alil metil cetona)
Propriedades Físicas de Aldeídos e Cetonas
O
O
CH3CH2CH2CH3
CH3CH2CH
CH3CCH3
CH3CH2CH2OH
butano
p.e. – 0,5 C
(MM = 58)
propanal
p.e. 49 C
(MM = 58)
acetona
p.e. 56,1 C
(MM = 58)
propanol
p.e. 97,2 C
(MM = 60)
Ligação de hidrogênio (aldeídos e cetonas X álcoois)
Solúveis em água: (ligações de hidrogênio entre as moléculas
dos aldeídos e/ou cetonas com moléculas de
água).
Reações de Oxidação-Redução em
Química Orgânica
A redução de uma molécula orgânica corresponde, normalmente,
ao aumento de seu conteúdo de hidrogênio ou à diminuição de
seu conteúdo de oxigênio.
[H] é o símbolo utilizado para indicar que houve redução sem
especificar o agente redutor.
A
oxidação
de
uma
molécula
orgânica
corresponde,
normalmente, ao aumento de seu conteúdo de oxigênio ou à
diminuição de seu conteúdo de hidrogênio.
[O] é o símbolo utilizado para indicar que houve oxidação sem
especificar o agente oxidante.
Síntese de Aldeídos
O
[O]
R-CH2OH
O
[O]
RCH
RCOH
[H]
[H]
álcool 1ário
aldeído
ácido carboxílico
Aldeídos por oxidação de álcoois primários
O
PCC
R-CH2OH
RCH
PCC = clorocromato de piridínio
CH2Cl2
Aldeídos por redução de ácidos carboxílicos
O
RCOH
LiAlH4
O
RCH
LiAlH4
R-CH2OH
Síntese de Cetonas
Cetonas a partir de alcinos
C
C
+ HOH
HgSO4
H2SO4
H
H
C
C
C
C
O
H
OH
álcool vinílico (instável)
cetona
Tautomerização ceto-enólica
H
+
O
H
H
H
+
O
H
C
C
C
OH
forma enólica
H
H
C
+
O
H
H
H
C
H
C
O
forma cetônica
+ H3O+
Grupo Carbonílico
C
O
+
C O
estruturas de ressonância
ou
C
d+
O
d
híbrido
O oxigênio (mais eletronegativo) atrai fortemente os elétrons de
ambas as ligações s e , fazendo com que o grupo carbonílico seja
altamente polarizado. O átomo de carbono carrega uma carga parcial
positiva substancial e o átomo de oxigênio carrega uma carga parcial
negativa substancial. A polarização da ligação pode ser
representada pelas estruturas de ressonância.
Adição Nucleofílica à Ligação
Dupla Carbono-Oxigênio
Nu
R
+
Nu
C
R'
O
d+ d
C
R
O
H Nu
Nu
C
R
R'
OH
+ Nu
R'
nucleófilo forte
Os aldeídos são mais reativos em adições nucleofílicas do que
as cetonas (fatores estéricos).
Ácidos Carboxílicos e Derivados
(Compostos Acílicos)
O
grupo carboxílico
C
OH
O grupo carboxílico é o grupo gerador de uma família enorme de compostos
chamados de compostos acílicos ou derivados de ácido carboxílico.
Estrutura
Nome do composto acílico
O
C
R
cloreto de acila (ou cloreto de ácido)
Cl
O
O
C
C
R
anidrido de ácido
R'
O
O
C
R
R
OR'
R C
N
éster
nitrila
O
O
O
C
C
C
NH2
R
NHR'
R
NR'R''
amida
Nomenclatura - Ácidos Carboxílicos
No sistema IUPAC, substitui o sufixo –ano do nome do alcano equivalente,
que corresponde à maior cadeia do ácido, pela adição –óico precedida pela
palavra ácido.
CH3
O
O
CH3CH2CHCH2CH2COH
CH3CHCHCH2CH2COH
ácido 4-metilhexanóico
ácido 4-hexenóico
Substância
Nome sistemático
Nome comum p.e. (oC)
HCOOH
ác. metanóico
ác. fórmico
100,5
H3CCOOH
ác. etanóico
ác. acético
118
H3C(CH2)2COOH
ác. butanóico
ác. butírico
164
H3C(CH2)3COOH
ác. pentanóico
ác. valérico
187
H3C(CH2)4COOH
ác. hexanóico
ác. capróico
205
H3C(CH2)16COOH
ác. octadecanóico
ác. esterárico
383
Sais de Ácidos Carboxílicos
Nomenclatura: São caracterizados pela terminação –ato, tanto na
sistemática IUPAC quanto na comum, substituindo-se o –ico do
nome e retirando a palavra ácido da frente.
CH3COONa: acetato de sódio ou etanoato de sódio
Os sais de sódio e de potássio da maioria dos ácidos carboxílicos são
facilmente solúveis em água, mesmo os de cadeias longas (principais
componentes dos sabões).
Acidez dos Ácidos Carboxílicos
A maioria dos ácidos carboxílicos não-substituídos possui valores de pKa
na faixa de 4-5. Esta acidez relativa explica porque os ácidos
carboxílicos reagem facilmente com soluções aquosas de NaOH e
NaHCO3 para formar sais de sódio solúveis.
COOH + NaOH
H2O
COONa+ + H2O
pKa 4,19
COOH + NaHCO3
H2O
COONa+ + CO2 + H2O
Cl
Cl
C
Cl
COOH
Cl
Cl
C
H
COOH
H
Cl
C
H
COOH
H
H
C
COOH
H
ác. tricloroacético
ác. dicloroacético
ác. cloroacético
ác. acético
pKa 0,70
pKa 1,48
pKa 2,86
pKa 4,76
Os ácidos carboxílicos que possuem grupos retirantes de elétrons são
mais fortes que os ácidos não-substituídos, devido ao efeito indutivo.
Ésteres
O
O
Ésteres são produtos de uma
reação de condensação
entre um ácido carboxílico e
+ HOR'
+ H
RCOR'
um álcool. Os ésteres são
nomeados
como se
fossem
“sais
de alquila” dos ácidos
RCOH
2O
carboxílicos.
O
O
RCOH + HOR'
RCOR' + H2O
Os nomes dos ésteres são formados a partir do ácido de onde provêm (com
terminação –ato ou –oato) e dos nomes do álcool (com a terminação –ila). A
palavra ácido do nome do ácido carboxílico é retirada e a contribuição do
nome relacionado ao álcool vem em segundo lugar.
O
O
O
C
CH3CH2
C
H3C
O
OC(CH3)3
acetato de etila ou
etanoato de etila
propanoato de
terc-butila
C
OCH2CH3
C
H3C
OCH2CH3
Cl
OCH=CH2
acetato de vinila ou
etanoato de vinila
p-clorobenzoato de
etila
Anidridos Carboxílicos
Os anidridos são, formalmente, derivados de duas moléculas de ácido carboxílico
pela remoção de uma molécula de água.
O
O
RCOH
RCOH
O
O
O
O
O
O
RCOCR' + H2O
+ HOCR'
RCOCR' + H2O
+ HOCR'
Os nomes da maioria dos anidridos são formados retirando-se a
palavra ácido do nome dos ácidos caboxílicos, e depois se adiciona a
palavra anidrido.
O
H3C
C
O
H3C
C
O
H3C
C
O
H3CH 2CH 2C
O
anidrido acético ou
anidrido etanóico
O
H2C
H2C
C
O
anidrido acético-butírico ou
anidrido butanóico-etanóico
C
O
C
O
anidrido succínico
Cloretos de Acila ou Cloretos de Ácido
Seus nomes são formados pela substituição da palavra ácido pela
palavra cloreto, e da terminação –ico pela terminação –ila.
O
O
O
C
H3C
Cl
cloreto de etanoila
ou cloreto de acetila
C
H5C6
C
H3CH2C
Cl
Cl
cloreto de benzoíla
cloreto de propanoila
Amidas
Os nomes das amidas que não possuem substituintes no átomo de N
são formados pela retirada da palavra ácido e terminação –ico do nome
comum do ácido (ou –óico do nome substitutivo), e então adiciona-se –
amida. Os grupos alquila no átomo de N das amidas são nomeados
como substituintes, sendo precedidos por –N ou –N,N.
H3C
O
O
C
C
H 5C 6
NH2
acetamida
O
C
NH2
benzamida
O
H3C
N
CH3
CH3
N,N-dimetilacetamida
C
H3C
N
C 6H 5
CH2CH2CH3
NHC2H5
N-etilacetamida
N-fenil-N-propilacetamida
C
H3C
O
Nitrilas
Na nomenclatura substitutiva da IUPAC, as nitrilas acíclicas são
denominadas pela adição do sufixo –nitrila ao nome do hidrocarboneto
correspondente. O átomo de carbono do grupo –C N é assinalado
como o número 1.
H3C C
N
etanonitrila
(acetonitrila)
H3CH2CH2C C
N
butanonitrila
H2C=HC C
N
Propenonitrila
(acrilonitrila)
Nitrilas cíclicas são nomeadas adicionando-se o sufixo –carbonitrila ao
nome do sistema de anel ao qual o grupo –CN está ligado.
CN
benzenocarbonitrila
(benzonitrila)
Preparação de ácidos carboxílicos
Por oxidação dos alcenos
RCH=CHR’
(1) KMnO4, OHRCOOH + R’COOH
calor
(2) H3O+
Por oxidação de aldeídos e álcoois primários
(1) Ag2O
R-CHO
RCOOH
(2) H3O+
RCH2OH
(1) KMnO4, OHcalor
(2) H3O+
RCOOH
Preparação de ácidos carboxílicos
Por oxidação de alquilbenzenos
CH3
(1) KMnO4, OHcalor
(2) H3O+
COOH
Por oxidação de metil cetonas
O
C
Ar
O
(1) X2/NaOH
CH3
(2) H3O+
+ CHX3
C
Ar
OH
Por hidrólise de cianoidrinas e outras nitrilas
R
O
R'
OH
R
+ HCN
C
R'
CN
HA
H2O
OH
R
C
R'
COOH
Ésteres
Os ácidos carboxílicos reagem com álcoois para formar ésteres
através de uma reação de condensação conhecida como
esterificação. Estas reações são catalisadas por ácidos.
O
O
HA
+ R'OH
C
R
C
R
OH
+ HOH
OR'
Mecanismo: esterificação catalisada por ácido
H
H
O
+ H
+
O
H
OH
H
2 etapas
H 5C 6
O
H
CH3
H
C
- CH3OH
H5C6
OH
H
+
O
O
H
C
H5C6
+
O
+ CH3OH
H5C6
H
O
C
O
H
C
H5C6
+
OCH3
H
O
+
C
O
O
H
O
- H3O+
+ H3O+
CH3
C
H5C6
OCH3
Ésteres
Ésteres a partir de cloretos de acila
Desde que cloretos de acila são muito mais reativos do que os ácidos
carboxílicos na reação adição-eliminação, a reação entre um cloreto de
acila e um álcool ocorre rapidamente e não necessita de um catalisador
ácido.
O
O
+ R'OH
C
R
+ HCl
C
R
Cl
OR'
Ésteres a partir de anidridos de ácidos carboxílicos
O
R
C
O
O + R'OH
R
O
+
C
R
C
O
OR'
C
R
OH
Ésteres
Hidrólise de éster catalisada por ácido
O
C
R
O
H3O+
+ H2O
OR'
C
R
+ R'OH
OH
Se necessitamos esterificar um ácido carboxílico, usamos um excesso de álcool e,
se possível, removemos a água assim que é formada. Se necessitamos hidrolisar
um éster, usamos um grande excesso de água; isto é, refluxamos o éster com HCl
aquoso diluído ou H2SO4 aquoso diluído.
Ésteres
Hidrólise de éster promovida por base: Saponificação
Refluxando um éster com NaOH aquoso, produzimos um álcool e o sal de
sódio do ácido:
O
+ NaOH
C
R
O
H2O
C
R
OR'
+ R'OH
O Na+
Mecanismo: hidrólise de um éster promovida por base
O
O
+
C
R
O
R'
O
H
R
O
O
lenta
C
O
O
R'
H
C
R
+ OO H
R'
C
R
O
+ HO
R'
Bibliografia
1. SOLOMONS, T.W.G.; FRYHLE, C.B. Química Orgânica. Rio de
Janeiro: LTC Editora. Vol 1, 7.ed., 2001; Vol 2, 7a ed., 2002.
(Capítulos 16, 17 e 18).
2. VOLLHARDT, K.P.C.; SCHORE, N.E. Química Orgânica:
Estrutura e Função. Porto Alegre: Bookman. 4.ed., 2004.
(Capítulos 17 a 20).
3. BARBOSA, L.C.A. Introdução à Química Orgânica. São Paulo:
Prentice Hall. 2004. (Capítulos 12 e 13).
4. McMURRY, J. Química Orgânica. São Paulo: Pioneira Thomson
Learning. Vol 1, 2005; Vol 2, 2005. (Capítulos 19 a 23).