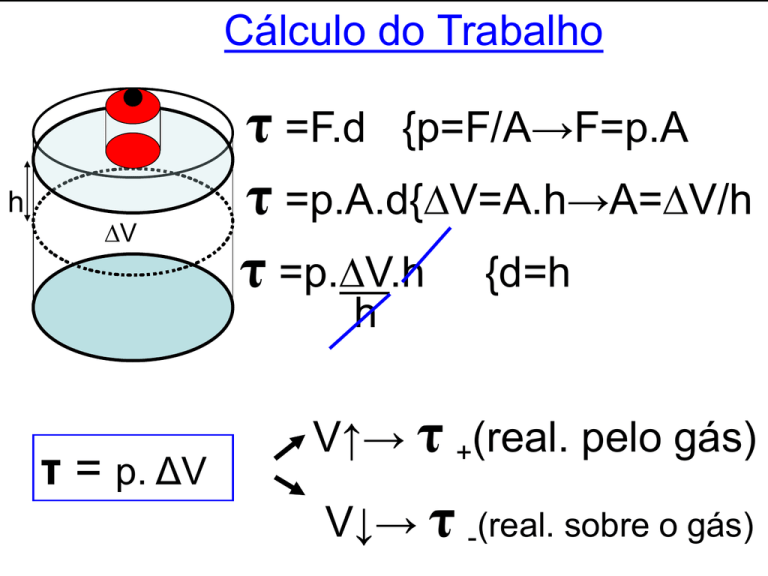
Cálculo do Trabalho
h
V
τ =F.d {p=F/A→F=p.A
τ =p.A.d{V=A.h→A=V/h
τ =p.V.h {d=h
h
τ = p. ΔV
V↑→ τ +(real. pelo gás)
V↓→ τ -(real. sobre o gás)
As Leis da Termodinâmica
• Trabalho Numa Transformação:
• Pressão(p) Constante.
• Fornece Calor › O Gás se Expande ›
Deslocamento do Êmbolo.
p.V p.(V2 V1 )
»
»
Expressão do
Trabalho Realizado
V > 0 > 0
V < 0 < 0
Expansão:
Compressão:
p
p
A
A
V
V
Vi
Vf
>0
Vf
Vi
<0
Energia Interna de um Gás
Só depende da temperatura absoluta (K)
do gás.
3
U nRT
2
•U↑ => T↑ => U+
•U↓ => T↓ => U•Uconst => T const => ΔU = 0
1a Lei da Termodinâmica
τ > 0 → energia mec. que sai do sistema
τ < 0 → energia mec. que entra no sistema
Q > 0 → calor que entra no sistema
Q < 0 → calor que sai do sistema
ΔU = U2 – U1
a
1
Lei
Variação da Energia
Interna
ΔU = Q - τ
Transformação Isobárica
• Pressão constante
•τ = p. ΔV
• ΔU = Q – τ
• ΔU = Q – p. ΔV
Sacola vedada, frouxa,
com peso em cima, ao
sol ou na geladeira.
Se o gás realizar mais trabalho que receber calor, então sua
energia interna diminuirá e vice-versa.
Transformação
Isobárica
p1.V1 p2 .V2
T1
T2
V1 V2
T1 T2
Volume e temperatura
absoluta são diretamente
proporcionais.
V
p2
p1
T(K)
Transformação Isotérmica
( T = constante )
p 0 V0 p1V1
p0 V0 p1V1
T0
T1
U = Q -
Q =
As Leis da Termodinâmica
• Transformações Gasosas:
– Transformação Isotérmica:
• Temperatura Constante. No
processo isotérmico Não há
variação de temperatura, mas há
troca de calor.
T = 0 U = 0 Q =
• Numa Transformação Isotérmica,
o calor trocado (Q) pelo gás com
o exterior é igual ao trabalho
realizado () no mesmo processo.
TRANSFORMAÇÕES ADIABÁTICAS
Ocorrem sem que haja trocas de calor
entre o sistema e o meio externo. Isto
geralmente é obtido num processo rápido.
Q=0
=>
U = Q - τ
U = - τ
Gás
τ(compressão)
OU
τ+
(expansão)
A
T>
B
T<
AB→Exp. Adiabática=> τ +=> U= - τ => U- => T↓
BA→Comp. Adiabática=> τ -=> U= - τ => U+ => T↑
***Este princípio é fundamental em
refrigeração!!!
Transformação Isométrica
• Volume constante
• Não realiza trabalho
ΔU = Q – τ
• ΔU = Q – 0
• ΔU = Q
τ=0
•
Panela de pressão
vedada com ar dentro,
ao fogo ou na
geladeira.
Todo calor absorvido pelo gás fica nele
mesmo, aumentando sua energia interna, e
vice-versa!
Transformação Isométrica
( V = constante )
p 0 V0 p1V1
T0
T1
U = Q -
p 0 p1
T0 T1
U = Q
Transformação Cíclica
P
U = 0
B
A
=A
D
Q=
C
V
horário:
>0
anti-horário:
<0
Máquinas térmicas
Q→τ
τ (En. Útil)
Q1
Fonte
Quente
M.T.
Q2 Fonte Fria
2ª Lei da Termodinâmica
Enunciado de Claussius
-É impossível haver um sistema que tenha
como único efeito transferir calor de uma fonte
fria para uma fonte quente.
-O calor não flui expontaneamente da fonte
fria para a fonte quente.
-Só é possível o calor passar da fonte fria
para a fonte quente se fornecermos energia
ao sistema
As Leis da Termodinâmica
• Conversão de Calor em Trabalho :
Máquina Térmica:
• Diferença de Temperatura.
• Para uma Máquina Térmica consiga converter calor em
trabalho de modo contínuo, deve operar em ciclo entre
duas fontes térmicas, uma quente e outra fria : retira
calor da fonte quente (Q!), convertendo - o
parcialmente em trabalho () e o restante (Q2) rejeita
para a fonte fria.
Rendimento
«
Q1 = Q 2 + τ
τ = Q 1 - Q2
ENEGIAÚTIL
»
ENERGIATOTAL
Q1
»
Q2
1
Q1
As Leis da Termodinâmica
• Ciclo de Carnot:
• Carnot demonstrou que, nesse ciclo, que as
quantidades de calor trocadas com as fontes
quente e fria são proporcionais às respectivas
temperaturas absolutas das fontes.
Q1 Q2
T1 T2
»
T2
1
T1
«
O rendimento do Ciclo de Carnot
é função exclusiva das
Temperaturas Absolutas das
fontes quente e fria, não
dependendo, portanto, da
substância “trabalhante”
utilizada. A expressão ao lado
fornece o Máximo Rendimento
de uma Máquina Térmica.
A máquina ideal de Carnot
Duas isotermas (AB e
CD)
Duas adiabáticas (BC
e DA)
MAX
T2
1
T1
Princípio de Carnot
"Nenhuma máquina térmica real,
operando entre 2 reservatórios térmicos
T1 e T2 , pode ser mais eficiente que a
"máquina de Carnot" operando entre os
mesmos reservatórios"
MAX 1
Q1
Q1 Q2
Q1
1
máx
1
Q2
Q1
T2
1
T1
2aLei da Termodinamica
***η → rendimento
A máquina ideal de Carnot
Ciclo reversível
A eficiência da Máquina de Carnot
No ciclo:
∆U=0 →
τ = Q1 - Q2
η = τ /Q1 = [Q1-Q2]/Q1 = 1 - Q2/Q1
Q2/Q1 = T2/T1
BC e DA = adiabáticas
AB e CD = isotérmas
η = (1 - Q2/Q1) = (1 - T2/T1)
η = 1 - T2/T1
Princípio de Carnot
"Nenhuma máquina térmica real, operando entre 2 reservatórios térmicos T1 e
T2 , pode ser mais eficiente que a "máquina de Carnot" operando entre os
mesmos reservatórios"
As Leis da Termodinâmica
Etapas do ciclo
de Carnot para
uma máquina
térmica
• Ciclo de Carnot:
Expansão
Isotérmica; o
gás retira Q1 da
fonte quente.
»
Não troca
Calor.
Expansão
Adiabática.
»
Compressão
Isotérmica : rejeita
Q2 para a fonte fria
»
»
Não troca
Calor:
Compressão
Adiabática












