Ácido, Base, Sais e Óxidos
•O que são ?
•Nomenclatura
•Função
•Aplicações
Nome: Gabriel Pedrosa, nº4
José Roberto nº7
O que são?
•
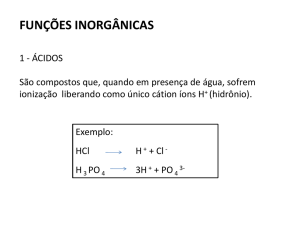
Ácido, no âmbito da química, é um composto capaz de transferir prótons (H+) numa
reação química – por tal pode ser chamado também de "doador de próton".
Numa solução aquosa pode reagir com a molécula de água formando o
íon oxônio (H3O+), diminuindo assim o pH da solução.
Ácidos também reagem com bases para formar sais numa reação de neutralização.
Sendo assim as bases são os análogos opostos aos ácidos.
Um ácido forte é aquele que se ioniza completamente na água, isto é, libera íons H+,
porém não os recebe. O exemplo anterior (ácido clorídrico) é um ácido forte. Outro é
o ácido nítrico.
Um ácido fraco também libera íons H+ , porém parcialmente, estabelecendo um
equilíbrio químico. A maioria dos ácidos orgânicos são deste tipo, e também alguns
sais como o cloreto de alumínio.
•
Uma base (também chamada de álcali) é qualquer substância que libera única e
exclusivamente o ânion OH– (íons hidroxila ou oxidrila) em solução aquosa.
Soluções com estas propriedades dizem-se básicas ou alcalinas. As bases possuem
baixas concentrações de iões H+ sendo considerado base as soluções que têm, a
25 °C, pH acima de 7.
•
Possuem sabor adstringente (ou popularmente, cica) e são empregadas como
produtos de limpeza, medicamentos (antiácidos) entre outros. Muitas bases, como o
hidróxido de magnésio (leite de magnésia) são fracas e não trazem danos. Outras
como o hidróxido de sódio (NaOH ou soda cáustica) são corrosivas e sua
manipulação deve ser feita com cuidado.
Sais, Em química, um sal é um composto de um cation ligado a um anion. Eles são
tipicamente o produto de uma reação química entre
Uma base e um ácido, formam um sal + água, ex.: 2NaOH + H2SO4 --> Na2SO4 +
2H2O sulfato de sódio
Um metal e um ácido, formam um sal + hidrogênio, ex.: Mg + H2SO4 --> MgSO4 +
H2 sulfato de magnésio
Um óxido ácido e um óxido básico, formando um sal, ex.: CO2 + CaO --> CaCO3
carbonato de cálcio.
Em geral, os sais são compostos iónicos que formam cristais. São frequentemente
solúveis em água, onde os dois iões se separam. Os sais em geral têm um alto
ponto de fusão, reduzida dureza e pouca compressibilidade. Se fundidos ou
dissolvidos em água, conduzem electricidade.
Os sais recebem o nome dos ions que os constituem. Nome do sal = Nome do ânion
de nome do cátion. Os cátions, metálicos ou amónio/NH4 são apresentados no final,
precedidos dos ânions, ex.: cloreto de potássio, acetato de sódio, etc. Os aniões
recebem o nome de acordo com o ácido que os formou.
•
Óxidos, Um óxido é um composto químico binário formado
por átomos de oxigênio com outro elemento em que o oxigênio é o mais
eletronegativo. Os óxidos constituem um grande grupo na química pois a maioria
dos elementos químicos formam óxidos. Alguns exemplos de óxidos com os quais
convivemos são: ferrugem (óxido de ferro III), gás carbônico(óxido de carbono IV
ou dióxido de carbono), cal (óxido de cálcio).
Nos óxidos, o elemento mais eletronegativo deve ser o oxigênio. Os compostos
OF2 ou O2F2 não são óxidos pois o flúor é mais eletronegativo que o oxigênio. Estes
compostos são chamados fluoretos de oxigênio.
Nomenclatura
•
•
•
•
•
•
•
•
•
•
•
•
•
•
ÁCIDOS
Para ácidos não oxigenados, usamos a terminação IDRICO. Exemplo:
HCl – ácido clorídrico
H2S – ácido sulfídrico
H2Se – ácido selenídrico
Para ácidos oxigenados, a coisa complica um pouco.
Se o elemento possuir somente uma valência, usamos a terminação ICO. Exemplo :
H2CO3 – ácido carbônico
H3BO3 – ácido bórico
Se o elemento tiver 2 valências, para a maior usamos ICO e para a menor OSO.
Exemplos :
H2SO3 – ácido sulfuroso
H2SO4 – ácido sulfúrico
HNO2 – ácido nitroso
HNO3 – ácido nítrico
• Se o elemento tiver 3 ou mais valências, usamos o prefixo HIPO
junto com o sufixo OSO, e o prefixo PER junto com o sufixo ICO,
nesta ordem.Exemplos :
• HClO – ácido hipocloroso
• HClO2 – ácido cloroso
• HClO3 – ácido clórico
• HClO4 – ácido perclórico
• Existem casos em que o elemento forma diversos ácidos, porém
sempre com a mesma valência. Usamos então os prefixos ORTO,
META e PIRO. Exemplos :
• H3PO4 – ácido ortofosfórico
• HPO3 – ácido metafosfórico
• H4P2O7 – ácido pirofosfórico
• Note que nos três ácidos o fósforo tem valência +5.
• BASES
• Se o elemento possuir somente uma valência, usamos a
expressão “hidróxido de” seguida do nome do elemento.
Exemplo :
• NaOH – hidróxido de sódio
• Ca(OH)2 – hidróxido de cálcio
• Se o elemento possuir duas valências, usamos a
expressão “hidróxido de” seguida do nome do elemento
e os sufixos OSO e ICO, ou então a valência em
números romanos. Exemplo :
• Fe(OH)2 – hidróxido ferroso ou hidróxido de ferro II
• Fe(OH)3 – hidróxido férrico ou hidróxido de ferro III
• ÓXIDOS
• Se o elemento possuir somente uma valência, usamos a expressão
“óxido de” seguida do nome do elemento. Exemplo :
• BaO – óxido de bário
• K2O – óxido de potássio
• Se o elemento possuir duas valências, usamos a expressão “óxido
de” seguida do nome do elemento e os sufixos OSO e ICO, ou
então a valência em números romanos. Exemplo :
• Cu2O – óxido cuproso ou óxido de cobre I
• CuO – óxido cúprico ou óxido de cobre II
• NiO – óxido niqueloso ou óxido de níquel II
• Ni2O3 – óxido niquélico ou óxido de níquel III
• SAIS
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Os sais derivam da reação de um ácido ou óxido com uma base.
Os sais sem oxigênio mudam a terminação IDRICO para a terminação ETO.
Exemplo :
CaS – sulfeto de cálcio, vem do ácido sulfídrico
RbH – fluoreto de rubídio, vem do ácido fluorídrico
Os sais oxigenados de menor valência mudam a terminação OSO para ITO.
Exemplo :
Na2SO3 – sulfito de sódio, vem do ácido sulfuroso
LiNO2 – nitrito de lítio, vem do ácido nitroso
Os sais oxigenados de maior valência mudam a terminação ICO para ATO.
Exemplo :
Na2SO4 – sulfato de sódio, vem do ácido sulfúrico
NaClO3 – clorato de sódio, vem do ácido clórico.
Os prefixos HIPO, PER, ORTO, META E PIRO são mantidos inalterados nos
sais, mudando apenas as terminações de OSO para ITO e de ICO para ATO.
Exemplos:
NaPO3 – metafosfato de sódio, vem do ácido metafosfórico
Ca2P2O7 – pirofosfato de cálcio, vem do ácido pirofosfórico.
Para terminar, os nomes dos cátions seguem as regras mencionadas acima
para as bases e o óxidos, usando os sufixos OSO e ICO ou algarismos
romanos para as valências.
Nomenclatura
•
•
•
•
•
•
•
•
•
Nomenclatura dos ácidos
a) Hidrácidos
ácido + elemento + ídrico
Exemplos:
= ácido iodídrico
= ácido clorídrico
= ácido sulfídrico
b) Oxiácidos
Como podem ser obtidos através da hidratação dos
óxidos ácidos, há a mesma sistemática de
nomenclatura.
• ácido + prefixo + elemento + sufixo
• noxprefixosufixo+1 ou +2hipooso+3 ou +4oso+5 ou +6-ico+7(hi)pericoObs: quanto menos
oxigênio, menor é o nox do elemento central e
quanto mais oxigênio, maior é o nox do mesmo,
como mostra os exemplos abaixo.
• Exemplos:
• = ácido hipocloroso (nox Cl = +1)
• = ácido cloroso (nox Cl = +3)
• = ácido clórico (nox Cl = +5)
• = ácido perclórico (nox Cl = +7)
•
•
•
•
•
•
•
Nomenclatura das bases
a) quando o cátion possui nox fixo
hidróxido de + cátion
Exemplo:
= Hidróxido de Potássio
b) quando o cátion não apresenta nox fixo
hidróxido de + cátion + sufixo OU hidróxido +
cátion + nox em algarismo romano
• Exemplos:
• = hidróxido de ferro II ou hidróxido ferroso
• = hidróxido de ferro III ou hidróxido férrico
Nomenclatura dos sais
a) para sais halóides
• ametal + eto de cátion
• Exemplo:
• = cloreto de sódio
• b) para oxissais
• Usamos uma
extensão da tabela de
óxidos ácidos e
oxiácidos, pois a
nomenclatura dos
oxissais também
depende do nox.
-
-
óxidos ácidos e
oxiácidos
oxissais
nox
prefixo
sufixo
sufixo
+1 ou +2
hipo
oso
ito
+3 ou +4
-
oso
ito
+5 ou +6
-
ico
ato
(hi)per
ico
ato
+7
• Exceções: Como os elementos B+3, C+4 e
Si+4 só possuem sufixo "ico" na forma de ácido,
quando sais, usa-se sempre o sufixo "ato".
• Exemplos:
• (nox N = +3) = nitrito de potássio
• (nox Cl = +1) = hipoclorito de sódio
• (nox Mn = +7) = permanganato de potássio
• Obs: quando na fórmula do sal há um
hidrogênio, acrescentamos o prefixo "bi" ao
nome do cátion.
• = bicarbonato de sódio
Aplicações
• No cotidiano temos as seguintes funções:
Ácido:
ácido muriático (ácido clorídrico) usado para limpeza de pedras em
passeios
Ácido bórico: usado para elaborar a água boricada - medicamento
para higiene dos olhos
Ácido sulfúrico: usado na bateria de automóveis
Ácido fosfórico: como estabilizante nos refrigerantes
Bases
hidróxido de sódio - é a soda caustica, usada para fazer sabão;
hidróxido de magnésio - usado como medicamento
hidróxido de alumínio - usado como antiácido (medicamento)
hidróxido de cálcio - cal usado para reboco nas construções
hidróxido de amônio - amoníaco hidratado
Sais
cloreto de sódio - principal componente do sal
de cozinha
carbonato de cálcio - mármore (usado para
pias e lápides)
óxidos
peróxido de hidrogênio - água oxigenada
dióxido de carbono - gás carbônico
monóxido de carbono - gás poluente