Março – Química Orgânica – 2ª Série
CAPACIDADE DE FORMAR CADEIAS
Os átomos de carbono têm a propriedade de se unir formando estruturas denominadas
cadeias carbônicas. Essa propriedade é a principal responsável pela existência
de milhões de compostos orgânicos.
Veja alguns exemplos de cadeias:
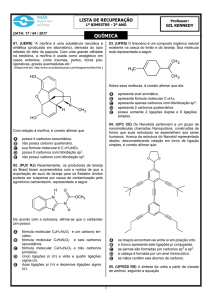
Existe outra maneira de representar a cadeia de um composto orgânico. Nesse tipo
de representação, não aparecem nem os carbonos nem os hidrogênios ligados aos carbonos.
As ligações entre os carbonos são indicadas por traços (—), localizando-se os carbonos
nos pontos de inflexão e nas extremidades dos traços.
Para simplificar ainda mais a representação, podemos indicar, por meio de índices,
a quantidade de átomos de hidrogênio e carbono presente na estrutura:
CLASSIFICAÇÃO DO CARBONO
Numa cadeia, cada carbono é classificado de acordo com o número de outros átomos
de carbono a ele ligados. Assim, temos:
1
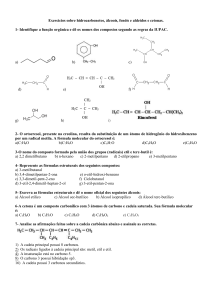
Agora, utilizando as definições vistas, vamos classificar todos os átomos de carbono
presentes na estrutura a seguir:
Observe que a presença de dupla ou tripla ligação não influi na classificação do carbono.
Uma outra maneira de classificar os carbonos é quanto ao tipo de ligação existente
em cada carbono:
a) saturado: quando apresenta quatro ligações simples
denominadas sigma
. Essas ligações são
.
b) insaturado: quando apresenta pelo menos uma ligação dupla
. Assim, temos:
2
ou então uma tripla
HIBRIDIZAÇÃO ou HIBRIDAÇÃO
Exercícios
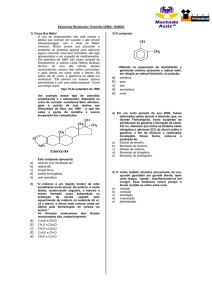
1) Estudo recente associou o consumo de batatas fritas na adolescência a um maior risco de câncer na vida
adulta.
O risco se deve à presença de acrilamida, produzida durante a fritura, quando a glicose e determinados
aminoácidos presentes na batata, como a asparagina, reagem entre si, conforme representado a seguir:
Sobre a acrilamida responda:
a) Qual a sua fórmula molecular?
RESPOSTA: C3H5NO
b) Quantos átomos de carbono sp2 existem em sua molécula?
RESPOSTA: TRÊS CARBONOS sp2
c) Quantos elétrons Pi existem em sua molécula?
RESPOSTA: QUATRO ELÉTRONS PI, POIS SÃO DUAS LIGAÇÕES PI.
3
2) Um dos analgésicos mais utilizados mundialmente é o ácido acetil-salicílico, ou aspirina, que possui
fórmula estrutural:
a) Qual é a fórmula molecular da aspirina?
RESPOSTA: C9H8O4
b) Quantos carbonos secundários ele contém?
RESPOSTA: CINCO
c) Quantos carbonos com hibridação sp2 e sp3, respectivamente, a molécula possui?
RESPOSTA: OITO sp2 E UM sp3
3) Na respiração aeróbica a glicose é convertida em ácido pirúvico (abaixo), o ácido piruvico entra na
MITOCONDRIA para a fase aeróbica da respiração. Na MATRIZ mitocondrial o ácido pirúvico perde Carbono,
oxigênio (Gás Carbônico) e Hidrogênio (mais NADH) e torna-se ácido acético que com auxilio da COENZIMA A
(Co-A) irá reagir num ciclo de KREBS para o desmonte total dos carbonos que formavam a glicose.
a) Qual é o número total de ligações sigmas e pi, respectivamente?
RESPOSTA: NOVE SIGMA E DUAS PI
b) Qual é a fórmula molecular do ácido pirúvico?
RESPOSTA: C3H4O3
c) Quantos carbonos sp2 e sp3 o ácido pirúvico apresenta?
RESPOSTA: DOIS sp2 E UM sp3
4