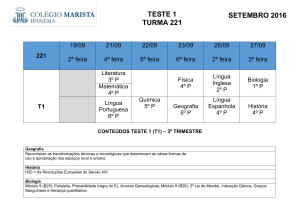
QUÍMICA IV
AULAS 28 A 30:
ELETRÓLISE
ANUAL
VOLUME 6
EXERCÍCIOS DE FIXAÇÃO
01. A solução aquosa de cloreto de sódio possui as seguintes espécies químicas: Na+, C–, H+, OH– e H2O. Durante a descarga temos
prioritariamente a migração da água para o cátodo e C– para o ânodo. Nesses dois eletrodos serão produzidos, respectivamente, gás
cloro e gás hidrogênio. Na cuba resta uma solução de hidróxido de sódio (soda cáustica).
Resposta: C
02. NaC(aq) → Na+(aq) + C–(aq)
H2O() → H+(aq) + OH–(aq)
Cátodo (–) : 2H+ + 2e– → H2
Ânodo (+) : 2C– → 2e– + C2
Resposta: C
03.
A) (F) Não é espontâneo por tratar-se de uma eletrólise.
B) (F) Os íons cloreto sofrem oxidação.
C) (F) O magnésio sofre oxidação.
D) (V) Magnésio metálico (redução) e gás cloro (oxidação) são produzidos nessa eletrólise.
Resposta: D
04.
R=
(
(
{
°
Cu2+ + 2e– → Cu
2 × 96500 C → 63,5 g
579 C → m
m = 0,19 g
mObtida
0,18 g
× 100% =
× 100%
mTeórica
0,19 g
R = 94, 7%
Resposta: A
05. Carga que passa pelo circuito: Q = it = 2,5 · 50 · 60 = 7500 C
De acordo com a estequiometria da reação, temos:
2 mol de elétrons → 1 mol de Cobre
2 · 96500 C
→ 63,5 g
7500 C →
m
m = 2, 47 g
Resposta: C
06. Revestir um metal com outro é denominado galvanização. O metal a ser revestido funciona como catodo do processo. Nesse caso,
a chave é o objeto enquanto a prata será o revestimento. Em uma eletrólise, o catodo é o polo negativo enquanto o anodo é o polo
positivo. A chave, portanto, corresponde ao polo negativo desse processo.
Resposta: D
07. O alumínio é reduzido e o oxigênio é oxidado durante eletrólise da bauxita.
Resposta: D
08. A obtenção de alumínio é feita através da eletrólise da bauxita com criolita, um fundente bastante utilizado.
Resposta: C
OSG.: 101090/16
Resolução – Química IV
09. As duas soluções são eletrolíticas e o bastão de grafite conduz eletricidade assim como o bastão de cobre.
Resposta: A
10. O objeto a ser galvanizado funciona como cátodo durante a Eletrólise. O cátodo é o polo negativo do processo.
Resposta: A
11. Aplica-se a lei de Faraday na estequiometria da eletrólise para o cálculo da massa de substância eletrolisada, e a fórmula Q = it, para
calcular carga, corrente e tempo.
Resposta: D
12.
A) (F) A concentração de Au3+ é mantida constante.
B) (F) O processo é de oxirredução.
C) (F) A carga que passa pelo circuito é de 1930 C. De acordo com a semirreação catódica do Au3+, a massa de ouro depositada é
1930 x 197
igual a
= 1, 31 g
3 x 96500
D) (V) Quanto maior o potencial de redução, maior a facilidade para reduzir.
E) (F) A peça a ser galvanizada é o cátodo da eletrólise.
Resposta: D
13. A eletrólise da salmoura gera gás hidrogênio, cloro e soda cáustica (solução impura de NaOH).
Resposta: C
14. No processo de purificação de cobre, impuro é oxidado a íon cobre II.
Resposta: C
15. Há apenas um erro: não é vapor e sim gás oxigênio, produzido na eletrólise aquosa de NaF.
Resposta: C
Raul: 11/05/16 – Rev.: LSS
10109016 - fix - Aulas 28 a 30 - Eletrólise
OSG.: 101090/16