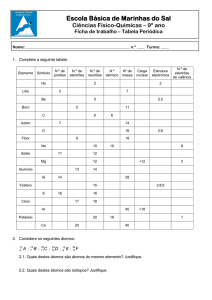
Disciplina de Didáctica da
Química I
Temas de Química
em espiral
Gil, V e Paiva, J. C.
1
2
3. TEMAS DE QUÍMICA
-
Nomenclatura Química
Fórmulas e Equações Químicas
Estrutura dos Átomos
Tabela Periódica dos Elementos
Ligação Química
Geometria das Moléculas
Mole e Quantidade Química
Tipos de Reacções Químicas
Cálculos Químicos (Concentrações, pH, Estequiométricos,...)
Trocas de Energia em Reacções Químicas
Cinética das Reacções Químicas
Extensão das Reacções e Equilíbrio Químico
Compostos de Carbono
Radiação Electromagnética e Matéria (cf. Física)
3. EXEMPLOS ESBOÇADOS
ESTRUTURA DOS ÁTOMOS NO ENSINO BÁSICO
E SECUNDÁRIO, segundo os programas actuais
8º ano
1. Estrutura corpuscular da matéria
a. Base experimental geral
b. Corpúsculos e estados físicos da matéria
c. Corpúsculos e diferenças de temperatura de amostras materiais
d. Corpúsculos, pressão e volume de um gás
e. Corpúsculos, temperatura e pressão de um gás
2. Constituição dos átomos: núcleo (e respectivas partículas) + electrões
9º ano
7. Estrutura e constituição dos átomos: evolução dos modelos atómicos
8. Base experimental para o modelo actual: núcleo + electrões
………
11. Tamanho e massa dos átomos: electrões e núcleos
………
14. Distribuição electrónica por níveis de energia para átomos de pequeno
número atómico: até Z=18, com extensão a Z=19 e 20 (por analogia)
10º ano
………
25. As estrelas como fábricas de átomos: fusão nuclear
27. Alteração da energia dos electrões e espectros como "impressões
digitais" de cada elemento: espectros de absorção e espectros de emissão
………
31. Quantização da energia do electrão no átomo H
………
38. Interpretação de diferenças em raio atómico e em energia de ionização
12º ano
………
41. A questão da energia de orbitais 3d e 4s, em relação com as configurações
electrónicas de K e Ca e dos elementos da 1ª série de metais de transição
………
44. Interpretação da cor de complexos octaédricos de metais da 1ª série de
transição em termos de transição de electrões entre dois sub-grupos de
orbitais 3d
LIGAÇÃO QUÍMICA NO ENSINO BÁSICO
E SECUNDÁRIO, segundo os programas actuais
8º ano
1. Modelos moleculares e geometria de moléculas simples
………
9º ano
………
4. Moléculas simples representadas por vários núcleos atómicos envolvidos por uma
nuvem electrónica
………
7. Noção de ligação covalente
………
11. Interpretação da ligação simples em F2 (e em Cl2) em termos de um balanço das
múltiplas interacções electrostáticas, sem prejuízo da partilha de todos os (14)
electrões de valência
…… …
13. Previsão de ligação dupla em O2 e tripla em N2 a partir das ligações em H2O e NH3
e respectiva representação, sem prejuízo da partilha de todos os electrões de
valência
14. Correlação/analogia da estabilidade das moléculas O2 e N2 (face à decomposição
em átomos) com a estabilidade do átomo do gás raro Ne (face à formação de iões)
………
21. Caracterização da ligação em metais pela partilha de electrões de valência em
estruturas gigantes
10º ano
………
26. Interpretação da ligação em H2 em termos da variação da energia
potencial de um sistema constituído por dois átomos H em função da
distância entre os respectivos núcleos
………
29. Relação entre energia de ligação CC e comprimento de ligação,
conforme se trate de liagção simples, dupla ou tripla
12º ano
………
34. Energia de rede cristalina em compostos iónicos
35. Ligação de hidrogénio
………
38. Interpretação da ligação química com base no conceito de orbital: breve
referência à teoria das ligações de valência e à teoria das orbitais moleculares
………
42. Caracterização da OM ligante e da OM anti-ligante na molécula H2
………
45. Aplicação dos diagramas de energia para as OM de N2, O2 e F2 e
justificação das respectivas ordens de ligação: 3, 2 e 1, respectivamente
………
47. Estabelecimento da ordem de ligação em moléculas poliatómicas com base
na regra do octeto
48. Caso particular da estrutura molecular do ozono e noção de híbrido de
ressonância
………
55. Ligação covalente polar e noção de electronegatividade dos átomos
………
60. Vários tipos de ligações intermoleculares: interacção de dipolos flutuantes,
interacção de dipolos permanentes, interacção dipolo permanente-dipolo
induzido e ligação de hidrogénio
………