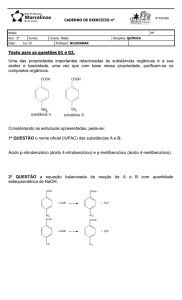
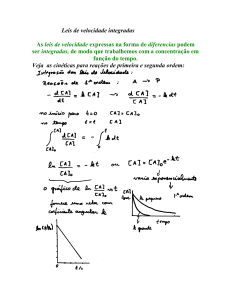
QUIMICA GERAL E EXPERIMENTAL I
LISTA DE EXERCÍCIOS
1) No processo de redução de minério de ferro para ferro metálico, a equação de uma das reações é a seguinte:
Fe2O3(s) +
CO(g) → Fe(s) + CO2(g)
(a) Balanceie a equação e dê o nome de todos os compostos nela presentes
(b) Qual é a massa máxima de ferro, em gramas, que pode ser obtida a partir de 454g de óxido de ferro
(c) Qual a massa de CO que é necessária para reduzir o óxido de ferro(III) a ferro metálico ?
2) A queima de carvão e óleo, para a geração de eletricidade, produz diversos poluentes, como, por exemplo,
dióxido de enxofre. Entretanto, este composto, contendo enxofre, pode ser removido da mistura de gases
poluentes através da seguinte reação:
SO2(g) + CaCO3(s) + O2(g) → CaSO4(s) + CO2(g)
(a) Balanceie a equação e dê o nome de todos os compostos nela presentes
(b) Qual a massa de CaCO3 necessária para remover 155g de SO2 ?
(c) Qual a massa de CaSO4 produzida quando 155g de SO2 são consumidos completamente ?
3) Cloreto de Alumínio é um reagente barato usado em muitos processos industriais. Ele é obtido tratando-se
sucata de alumínio com cloro, com a seguinte equação:
Al(s) + Cl2(g) → AlCl3(s)
(a) Balanceie a equação
(b) Qual o reagente limitante, se 2,70g de Al e 4,05g de Cl2 são misturados?
(c) Que massa de AlCl3 pode ser produzida a partir da mistura de 2,70g de Al e 4,05g de Cl2 ?
(d) Qual a massa do reagente em excesso remanescente após a reação se completar ?
4) A reação entre o metano e a água é uma maneira de se preparar hidrogênio, conforme a equação não
balanceada a seguir:
CH4(g) + H2O(g) → CO(g) + H2(g)
Se a reação começar com uma mistura de 995g de CH4 e 2510g de água, qual a máxima quantidade de H2 que
pode ser produzida ?
5) O metanol é um combustível de queima limpa e fácil de se manusear. Ele pode ser obtido pela reação direta
entre CO e H2 (que se obtém pela reação entre o vapor de água e o carvão a quente):
CO(g) + H2(g) → CH3OH(g)
Numa mistura de 12,0g de H2 e 74,5g de CO, qual é o reagente limitante ? Que massa do reagente em excesso
restará após a reação se completar ? Qual é a produção teórica do metanol ?
6) O dicloreto de dienxofre é usado na vulcanização de borracha. Ele pode ser obtido no tratamento do enxofre
fundido pelo cloro gasoso, conforme a equação não balanceada:
S8(l) + Cl2(g) → S2Cl2(l)
Numa mistura inicial de 32,0g de enxofre e 71,0g de Cl2, qual é o reagente limitante ? Que massa de S2Cl2 pode
ser obtida ? Que massa do reagente em excesso resta depois do término da reação ?
7) O gás amoníaco pode ser preparado pela reação entre um óxido metálico, como por exemplo óxido de cálcio,
e o cloreto de amônio, conforme a equação a seguir não balanceada:
CaO(s) + NH4Cl(s) → NH3(g) + H2O(g) + CaCl2(s)
Se 112g de CaO e 224g de NH4Cl forem misturados, qual é a produção máxima possível de NH3 ? Que massa
do reagente em excesso resta depois de ser formada a quantidade máxima do amoníaco ?
8) A aspirina (C9H8O4) é produzida pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3).
C7H6O3(s) + C4H6O3(l) → C9H8O4(s) + CH3CO2H(aq)
A aspirina (C9H8O4) é produzida pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3).
Se forem misturados 100g de cada reagente, qual é a massa máxima de aspirina que pode ser produzida ?
9) O gás amoníaco pode ser preparado pela seguinte reação:
CaO(s) + NH4Cl(s) → NH3(g) + H2O(g) + CaCl2(s)
Se 103g de amoníaco forem obtidos, mas a produção teórica for de 136g, qual o rendimento percentual deste
gás ?
10) A diborana é um composto importante na síntese de novos compostos orgânicos. Uma das diversas
maneiras de preparação deste composto é através da reação (não balanceada):
NaBH4(s) + I2(s) → B2H6(g) + NaI(s) + H2(g)
Suponhamos que se usem 1,203g de NaBH4 com iodo em excesso e se obtenha 0,295g de B2H6. Qual o
rendimento percentual de B2H6 ?
11) Na reação entre o Zinco e o cloro:
Zn(s) + Cl2(g) → ZnCl2(s)
Qual a produção teórica de ZnCl2, quando 35,5g de zinco reagem com cloro em excesso ? Se forem obtidos
apenas 62,5g de cloreto de zinco, qual o rendimento percentual deste composto ?
12) O dicloreto de dienxofre pode ser preparado, além da reação entre o S8 e o Cl2 pela seguinte reação (não
balanceada):
SCl2(l) + NaF(s) → SF4(g) + S2Cl2(l) + NaCl(s)
Admita que se principie com 5,23g de SCl2 e NaF em excesso. Qual a produção teórica de S2Cl2 ? Se forem
obtidos somente 1,19g de S2Cl2, qual o rendimento do composto ?
13) Quantos mililitros de HNO3 0,125 M são necessários para reagir completamente com 1,30g de Ba(OH)2 ?
2 HNO3(aq) + Ba(OH)2(s) → Ba(NO3)2(aq) + 2 H2O(l)
14) A diborana (B2H6) pode ser preparada através da seguinte reação:
2 NaBH4(aq) + H2SO4(aq) → 2 H2(g) + Na2SO4(aq) + B2H6(g)
Quantos mililitros de H2SO4 0,0875 M reagem com 1,35g de NaBH4 ? Qual a massa de B2H6 produzida ?
15) Quantos mililitros de solução de Pb(NO3)2 0,0750 M reagem com 1,00 L de solução de NaCl 2,25 M ?
Pb2+(aq) + 2 Cl (aq) → PbCl2(s)
16) Latas de alumínio podem ser dissolvidas em solução básica, por exemplo de hidróxido de potássio:
2 Al(s) + 2 OH-(aq) + 6 H2O(l) → 2 Al(OH)4-(aq) + 3 H2(g)
Colocando-se 2,05g de alumínio em um béquer com 125 mL de KOH 1,25 M restará algum alumínio ? Que
massa de Al(OH)4- é produzida ?
17) Para analisar um composto de ferro, todo o ferro é convertido a Fe2+ em solução e depois titulado com
solução aquosa de MnO4-, conforme a equação iônica líquida a seguir, não balanceada:
MnO4 (aq) + Fe2+(aq) + H+(aq) → Mn2+(aq) + Fe3+(aq) + H2O(l)
Se uma massa de 0,598g de uma amostra que contém ferro consome 22,25 mL de solução de MnO4- 0,0123 M
na titulação, qual a percentagem ponderal (pureza) de ferro na amostra ?
18) 500 mL de HCl 2,50 M são misturados com 250 mL de HCl 3,75 M. Qual a concentração de HCl na
solução resultante ?
19) A reação seguinte pode ser usada para preparar iodo no laboratório
NaI(s) + H2SO4(conc) + MnO2(s) → Na2SO4(aq) + MnSO4(aq) + I2(g) + H2O(l)
(a) Qual é o reagente oxidante e qual o agente redutor ?
(b) Qual a quantidade de iodo que pode ser obtida se 20,0g de NaI estão misturados com 10,0g de MnO2 (em
excesso de H2SO4)
20) Dissolve-se ouro de uma rocha pelo ataque com cianeto de sódio na presença de oxigênio, conforme a
seguinte equação (não balanceada):
Au(s) + CN (aq) + O2(g) + H2O(l) → Au(CN)2 (aq) + OH (aq)
Se existe exatamente uma tonelada (1000 Kg) de rocha, quantos litros de solução de CN- 0,075 M devem ser
usados para a extração do ouro, sabendo-se que a presença do ouro na rocha é de 0,019% ?