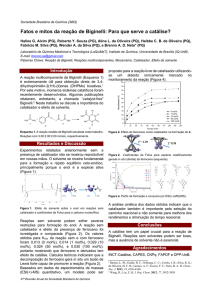
QUÍMICA - 2o ANO
MÓDULO 15
CINÉTICA QUÍMICA EXERCÍCIOS
Fixação
F
1) (UERJ) A sabedoria popular indica que, para acender uma lareira, devemos utilizar inicial-2
mente lascas de lenha e só depois colocarmos as toras.
Em condições reacionais idênticas e utilizando massas iguais de madeira em lascas e em
toras, verifica- -se que madeira em lascas queima com mais velocidade.
O fator determinante, para essa maior velocidade da reação, é o aumento da:
I
a) pressão; c) concentração;
I
b) temperatura; d) superfície de contato.
I
I
V
a
b
c
d
e
Fixação
-2) (UEL) A decomposição do peróxido de hidrogênio pode ser representada pela equação:
1 H2O2(l) → 1 H2O(l) + 1/2 O2(g) ∆H < 0
Dadas seguintes condições:
I) 25ºC e ausência de luz
II) 25ºC e presença de catalisador
III) 25ºC e presença de luz
IV) 35ºC e ausência de luz
V) 35ºC e presença de catalisador
Aquela que favorece a conservação do peróxido de hidrogênio é:
a) I b) II c) III
d) IV
e) V
Fixação
F
3) (UNEB) A energia de ativação da reação A + B → C + D, quando feita com catalisador, vale:4
c
r
a) 10 kcal b) 20 kcal c) 30 kcal
Entalpia em kcal
90
60
50
C+D
30
0
A+B
Caminho da reação
d) 50 kcal
e) 90 kcal
a
b
c
Fixação
4) (UFPB) A tabela abaixo indica valores das velocidades de reação e as correspondentes
concentrações, em mol/L, dos reagentes, em idênticas condições, para o processo químico
representado pela equação:
3X + 2Y → 1Z + 5 W
V(mol x L x
min-1)
[X]
[Y]
10
5
10
40
10
10
40
10
20
-1
A equação de velocidade desse processo é:
a) v = k x [X]3 x [Y]2 d) v = k x [X]2 x [Y]0
2
2 b) v = k x [X] x [Y]
e) v = k x [X]2 x [Y]3
c) v = k x [X]0 x [Y]2
Fixação
F
5) (UFRN) O Haber é um importante processo industrial para produzir amônia, conforme a6
reação:
1N2(g) + 3H2(g) → 2 NH3(g)
Colocados, num reator, nitrogênio e hidrogênio, obtiveram-se os seguintes dados em minutos e mols/litro:
∆t (min)
[N2]
[H2]
[NH3]
0
0,50
1,50
-
10
0,45
1,35
0,10
Calculando-se a velocidade média em função de NH3, N2, H2 e a velocidade média da rea-a
ção, obtêm-se, respectivamente:
b
a) 0,01; -0,005; -0,015 e 0,005 mol x litro-1 x min-1
c
b) 0,01; 0,135; 0,045 e 0,005 mol x litro-1 x min-1
d
c) 0,01; 0,005; 0,015 e 0,005 mol x litro-1 x min-1
e
d) 0,01; -0,130; -0,045 e 0,005 mol x litro-1 x min-1
e) 0,01; 1,350; 0,450 e 0,005 mol x litro-1 x min-1
Fixação
6) (UFSCAR) A decomposição do pentóxido de dinitrogênio é representada pela equação:
2 N2O5(g) → 4 NO2(g) + O2(g)
Foram realizados três experimentos, apresentados na tabela.
experimento
[N2O5]
velocidade
I
x
4z
II
x/2
2z
III
x/4
z
A expressão da velocidade da reação é:
a) v = k [N2O5]0
b) v = k [N2O5]1/4
c) v = k [N2O5]1/2
d) v = k [N2O5]1
e) v = k [N2O5]2
Fixação
7) (UFMG) A tabela mostra resultados de experiências em que comprimidos de antiácido efervescente foram dissolvidos em água.
Tempo para se
completar a dissolução (min)
Estado do comprimido
Temperatura da
água (ºC)
Inteiro
20
1
Inteiro
30
0,5
Pulverizado
20
0,7
Pulverizado
40
0,2
Considerando-se os resultados da tabela e os fatores que, em geral, influenciam as velocidades de reação, todas as alternativas estão corretas, exceto:
a) A pulverização aumenta a energia cinética das partículas.
b) A pulverização aumenta a frequência de colisões das partículas do comprimido com moléculas de água.
c) A velocidade de dissolução depende de mais de um fator.
d) O aquecimento aumenta a energia média das colisões.
e) O aumento da superfície de contato favorece a dissolução.
Fixação
-8) (ESAL) Das proposições abaixo, relacionadas com cinética química, a única falsa é:
a) A velocidade de uma reação pode ser medida pelo consumo de reagentes na unidade de
tempo.
b) A colisão entre as partículas químicas é necessária para que haja reação.
c) Temperatura e catalisadores são fatores que influenciam na velocidade de reação.
d) A concentração dos reagentes afeta a velocidade de reação.
e) A natureza dos reagentes não exerce influência na velocidade de reação.
-
-
9) (UERJ) A fim de aumentar a velocidade de
formação do butanoato de etila, um dos componentes do aroma de abacaxi, emprega-se
como catalisador o ácido sulfúrico. Observe a
equação química desse processo:
O
O
OH
+
H 2 SO4
HO
O
+ H2O
com catalisador
sem catalisador
tempo
concentração
b)
concentração
As curvas de produção de butanoato de
etila para as reações realizadas com e sem a
utilização do ácido sulfúrico como catalisador
estão apresentadas no seguinte gráfico:
a)
com catalisador
sem catalisador
tempo
concentração
c)
com catalisador
sem catalisador
tempo
d)
concentração
Fixação
com catalisador
sem catalisador
tempo
Proposto
[H2] (mol x L-1 )
1) (UERJ) O gráfico abaixo representa a variação, em função do tempo, da concentração, em
quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
metálico com solução concentrada de ácido clorídrico. Estas reações são realizadas sob as
mesmas condições, diferindo, somente, quanto às formas de apresentação do alumínio: placas
metálicas e pó metálico.
1,2
I
1,0
0,8
0,6
II
0,4
0,2
0
1
2
3
tempo (min)
a) Calcule a razão entre a maior e a menor velocidade média da reação.
b) Defina a que forma de apresentação do alumínio corresponde cada uma das curvas. Justifique sua resposta.
Proposto
2) (UFRJ)
O grito de Satanás nas melancias
Possantes candeeiros a carbureto iluminam a sala espaçosa pintada a óleo, refletindo a
luz forte nas lentes escuras que protegem os grandes olhos firmes do poeta, sob as grossas
pestanas negras.
(Orlando Tejo. Zé Limeira, Poeta do Absurdo)
Em duas lanternas idênticas, carregadas com a mesma massa de carbureto, goteja-se
água, na mesma vazão, sobre o carbureto. Na lanterna I, o carbureto encontra-se na forma de
pedras e, na lanterna II, finamente granulado.
a) Indique qual das lanternas apresentará a chama mais intensa.
b) Indique qual delas se apagará primeiro. Justifique sua resposta, com base em seus conhecimentos de cinética química.
Proposto
velocidade de degradação (mg/(L.h))
3) (UFRJ) O aspartame é um adoçante usado em bebidas lácteas dietéticas. A reação de
degradação do aspartame nessas bebidas apresenta cinética de primeira ordem em relação
a sua concentração. O gráfico a seguir relaciona a velocidade de degradação do aspartame
com concentração, nas temperaturas de 4ºC e 20ºC.
0,75
20ºC
4ºC
0,50
0,25
0,00
200
180
160
140
120
100
concentração de aspartame (mg/L)
a) Dois frascos, A e B, têm a mesma concentração
inicial de aspartame,
200 mg/L, mas o primeiro está armazenado a 20ºC e o segundo a 4ºC.
eb) Determine a razão entre as constantes de velocidade da reação de degradação do aspartame
nos frascos A e B. Justifique sua resposta.
-
Proposto
P
5
4) (UNESP) Explique, cientificamente, as seguintes observações experimentais:
a) Uma barra de ferro aquecida em uma chama branda não altera muito seu aspecto visual.
Contudo, se sobre esta mesma chama se atira limalha de ferro, verifica-se que as partículas
da limalha se tornam incandescentes.
b) A adição de níquel metálico, finamente dividido, aumenta a velocidade da reação entre C2H4(g)
e H2(g) para produzir C2H6(g).
a
b
Proposto
5) (PUC) Os dados a seguir referem-se à equação: 3A + B + C → A2B + AC, realizada a 25ºC.
.
[A]
[B]
[C]
V (mol/L x s)
0,5
0,5
0,5
0,02
0,5
0,5
1,0
0,02
0,5
1,0
0,5
0,04
1,0
0,5
0,5
0,08
Baseando-se nessas informações, responda:
a) Qual é a equação da velocidade dessa reação?
b) O processo é elementar? Justifique a sua resposta.
P
Proposto
Concentração
6) (UNICAMP) Soluções aquosas de água oxigenada, H2O2, decompõem-se dando água e gás7
oxigênio. A figura a seguir representa a decomposição de três soluções de água oxigenada ema
p
função do tempo, sendo que uma delas foi catalisada por óxido de ferro (III), Fe2O3.
a
p
1
2
3
Tempo
a) Qual das curvas representa a reação mais lenta? Justifique em função do gráfico.
b) Qual das curvas representa a reação catalisada? Justifique em função do gráfico.
Proposto
7) (FUVEST) Para remover uma mancha de um prato de porcelana fez-se o seguinte: cobriu-se
a mancha com meio copo de água fria, adicionaram-se algumas gotas de vinagre e deixou-se
por uma noite. No dia seguinte a mancha havia clareado levemente.
Usando apenas água e vinagre, sugira duas alterações no procedimento, de tal modo que
a remoção da mancha possa ocorrer em menor tempo. Justifique cada uma das alterações
propostas.
Proposto
P
8) (IME) Uma mistura gasosa ideal de propano e ar é queimada a pressão constante, gerando9
720 litros de CO2 por hora, medidos a 20°C. Sabe-se que o propano e o ar encontram-se emd
proporção estequiométrica.
a
Determine a velocidade média de reação da mistura em relação ao ar, considerando a
composição do ar 21% de O2 e 79% de N2 em volume.
a
b
Proposto
9) (UNICAMP) O gráfico a seguir representa as variações das massas de um pequeno pedaço
de ferro e de uma esponja de ferro (palha de aço usada em limpeza doméstica) expostos ao
ar (mistura de nitrogênio, N‚ oxigênio, O, e outros gases além de vapor-d’água).
Massa
b
a
Tempo
a) Por que as massas da esponja e do pedaço de ferro aumentam com o tempo?
b) Qual das curvas diz respeito à esponja de ferro? Justifique.
P
Proposto
10) (UFRJ) A expressão da velocidade de uma reação deve ser determinada experimentalmente,1
não podendo, em geral, ser predita diretamente a partir dos coeficientes estequiométricos dai
reação.
u
O gráfico a seguir apresenta dados experimentais que possibilitam a obtenção da expressãoe
da velocidade da seguinte reação:
i
f
2 ICℓ(g) + H2(g) → I2(g) + 2 HCℓ(g)
u
velocidade
a
inicial (mol/L.s)
[ IC ] = 3,0
q
[ IC ] = 1,5
g
7,4 x 10
-7
3,7 x 10
-7
1,5
Escreva a expressão da velocidade desta reação.
3,0
[H2]
ç
e
s
Proposto
,11) (UFRJ) Um dos métodos de preparação de
iodeto de hidrogênio com alto grau de pureza
utiliza a reação direta entre as substâncias iodo
e hidrogênio. Num experimento, 20 mols de
iodo gasoso e 20 mols de hidrogênio gasoso
foram colocados em um reator fechado com
um volume útil igual a 2 litros. A mistura foi
aquecida até uma determinada temperatura,
quando ocorreu a reação representada a seguir. Considere a reação irreversível.
H2(g) + I2(g) → 2 HI(g)
No experimento, a variação da concentração de H2(g) com o tempo de reação foi medida
e os dados foram representados no gráfico a
seguir:
[H2] mol/L
10
8
6
4
2
0
2
4
6
8
10 12 14 16 18 20 22 24 26 28 30
tempo (min)
a) Calcule a velocidade inicial da reação.
b) Calcule a concentração de iodeto de hidrogênio após 10 minutos de reação.