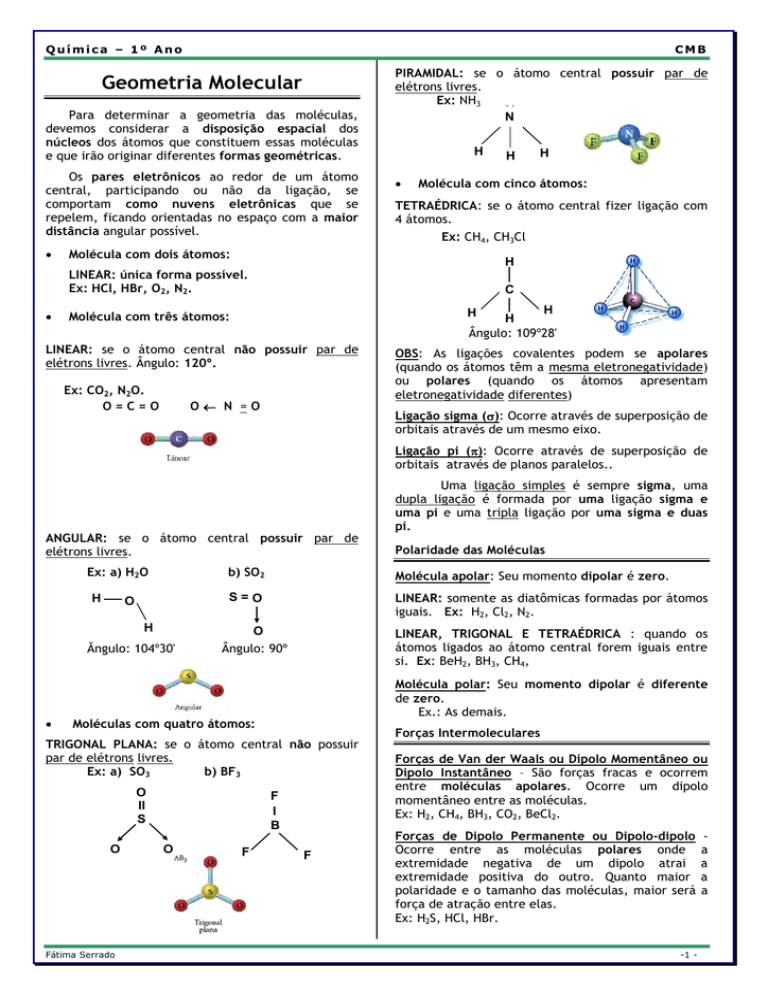
Química – 1º Ano
CMB
Geometria Molecular
Para determinar a geometria das moléculas,
devemos considerar a disposição espacial dos
núcleos dos átomos que constituem essas moléculas
e que irão originar diferentes formas geométricas.
Os pares eletrônicos ao redor de um átomo
central, participando ou não da ligação, se
comportam como nuvens eletrônicas que se
repelem, ficando orientadas no espaço com a maior
distância angular possível.
PIRAMIDAL: se o átomo central possuir par de
elétrons livres.
Ex: NH3
..
N
H
TETRAÉDRICA: se o átomo central fizer ligação com
4 átomos.
Ex: CH4, CH3Cl
Molécula com dois átomos:
H
C
H
H
Ângulo: 109º28'
H
Molécula com três átomos:
LINEAR: se o átomo central não possuir par de
elétrons livres. Ângulo: 120º.
Ex: CO2, N2O.
O=C=O
H
Molécula com cinco átomos:
LINEAR: única forma possível.
Ex: HCl, HBr, O2, N2.
H
O N =O
OBS: As ligações covalentes podem se apolares
(quando os átomos têm a mesma eletronegatividade)
ou polares (quando os átomos apresentam
eletronegatividade diferentes)
Ligação sigma (): Ocorre através de superposição de
orbitais através de um mesmo eixo.
Ligação pi (): Ocorre através de superposição de
orbitais através de planos paralelos..
ANGULAR: se o átomo central possuir par de
elétrons livres.
Ex: a) H2O
H
O
Molécula apolar: Seu momento dipolar é zero.
S=O
LINEAR: somente as diatômicas formadas por átomos
iguais. Ex: H2, Cl2, N2.
O
LINEAR, TRIGONAL E TETRAÉDRICA : quando os
átomos ligados ao átomo central forem iguais entre
si. Ex: BeH2, BH3, CH4,
Ângulo: 90º
Molécula polar: Seu momento dipolar é diferente
de zero.
Ex.: As demais.
Moléculas com quatro átomos:
TRIGONAL PLANA: se o átomo central não possuir
par de elétrons livres.
Ex: a) SO3
b) BF3
O
II
S
O
Fátima Serrado
F
I
B
O
Polaridade das Moléculas
b) SO2
H
Ãngulo: 104º30'
Uma ligação simples é sempre sigma, uma
dupla ligação é formada por uma ligação sigma e
uma pi e uma tripla ligação por uma sigma e duas
pi.
F
F
Forças Intermoleculares
Forças de Van der Waals ou Dipolo Momentâneo ou
Dipolo Instantâneo – São forças fracas e ocorrem
entre moléculas apolares. Ocorre um dipolo
momentâneo entre as moléculas.
Ex: H2, CH4, BH3, CO2, BeCl2.
Forças de Dipolo Permanente ou Dipolo-dipolo
Ocorre entre as moléculas polares onde
extremidade negativa de um dipolo atrai
extremidade positiva do outro. Quanto maior
polaridade e o tamanho das moléculas, maior será
força de atração entre elas.
Ex: H2S, HCl, HBr.
-1 -
a
a
a
a
Química – 1º Ano
CMB
Pontes de Hidrogênio - Ocorrem quando a molécula
possui hidrogênio ligado a um elemento muito
eletronegativo: flúor (F), Oxigênio (O) ou nitrogênio
(N).
(3)
Obs: quanto maior o ponto de ebulição, maior é a
força de atração entre as moléculas. Essa força é
caracterizada de moléculas polares contendo átomos
de hidrogênio ligados a átomos muito eletronegativos
da outra.
Ex: NH3, H2O, HF.
(5)
Propriedades das Substâncias
Ponto de fusão e de ebulição - quanto maior a força
elétrica que mantém os átomos, moléculas ou íons
unidos, maiores são seus pontos de fusão e de
ebulição. As substâncias iônicas são as que têm
maiores pontos de fusão e de ebulição, pois as
forças de atração entre os íons são fortes. Nas
moléculas polares são baixos, e nas apolares são
extremamente baixos.
Solubilidade
Para haver uma solução é necessário que:
As interações elétricas entre as partículas de
soluto-soluto, solvente-solvente e soluto-solvente
sejam rompidas;
OBS: "Semelhante dissolve semelhante":
Substância polar dissolve substância polar.
Substância apolar dissolve substância apolar.
Condutividade elétrica
A corrente elétrica resulta do movimento
ordenado de cargas elétricas (íons ou elétrons).
Conduzem a eletricidade:
Metais, por possuírem nuvem eletrônica;
Substâncias iônicas, quando fundidas ou em
soluções aquosas, pois seus íons estão em
movimento;
Obs: Os compostos moleculares não conduzem a
eletricidade nem no estado sólido nem no estado
líquido, pois suas moléculas não apresentam cargas
elétricas livres.
Exercícios
1) (UnB) O carbono, nome dado por Lavoisier em
1789, é de fundamental importância na
constituição dos compostos orgânicos.
Existem pelo menos 7 (sete) formas alotrópicas:
grafite (alfa e beta), diamante, lonsdaleíta
(diamante hexagonal), caoíta, carbono (VI) e os
fulerenos.
(4)
2) (Unesp-SP) Dois elementos, X e Y estão bem
separados na fila de reatividade química. Se X
tem 1 elétrons na última camada e Y tem 6
elétrons, o composto formado será:
a) molecular e de fórmula XY2;
b) molecular e de fórmula X2Y;
c) iônico e de fórmula X2Y;
d) iônico e de fórmula XY2;
e) iônico e de fórmula X6Y.
(c)
3) (UM-SP) A fórmula do composto formado por
átomos de um elemento químico X, de número
atômico 12, e átomos de um elemento químico Y,
de número atômico 17, será:
a) XY2;
d) X2Y3;
b) XY;
e) X3Y2.
c) X2Y;
(a)
4) (OSEC-SP) Num composto, sendo X o cátion, Y o
ânion e X2Y3, a fórmula, os átomos X e Y, no
estado normal, os prováveis números de elétrons
na última camada são, respectivamente:
a) 2 e 3;
d) 3 e 6;
c) 2 e 5;
b) 3 e 2;
e) 5 e 6.
(d)
5) (ITA-SP) Esta questão refere-se à classificação
periódica dos elementos, esquematizados a
seguir. Os símbolos dos elementos foram
substituídos
por
letras
arbitrariamente
escolhidas. A letra T representa o símbolo de um
gás nobre.
1
(2)
O carbono no comporto metano (CH4), com 4
(quatro) elétrons na camada de valência,
possui estrutura trigonal plana.
O clorofórmio, CHCl3, substância polar, é
totalmente solúvel em benzeno, C6H6,
substância apolar.
Fátima Serrado
8
V
2
X
M
Y
5
G
U
J
Q
6
D
L
7
W
R
Z
T
Baseado na posição dos elementos mencionados na
tabela periódica anterior, a fórmula falsa é:
a) X2L;
b) YW2;
c) M2J3;
d) QW3;
e) GR4.
(c)
6)
(Fuvest-SP) Escolha, entre as fórmulas dadas a
seguir, aquela que representa a substância de
maior caráter iônico:
a) HF;
c) ICl;
b) CsCl
d) Na2.
(b)
7)
(UFCE) Selecione as alternativas onde não há
exata correspondência entre a molécula e sua
forma geométrica:
a) N2 - Linear.
d) CCl4 - tetraédrica
b) CO2 - Linear. e) BF3 - pirâmide trigonal
c) H2O - Angular;
(e)
Consultando a tabela periódica, julgue os itens,
com relação ao carbono.
(1)
O carbono, elemento presente em todos os
seres vivos, origina um ramo importante da
química, a Química orgânica.
O carbono 12 (12C) possui 12 (doze) prótons no
seu núcleo.
O carbono combina-se com elementos da
família 7A, formando compostos de fórmula
CX4 (onde X representa halogênio).
EECEC
-2 -
Química – 1º Ano
8)
CMB
(PUC-SP) Considere uma substância X:
I.
Em condições ambientais é sólida;
II.
Dissolve-se em água;
III. Possui alto ponto de fusão;
IV. No estado sólido não conduz eletricidade;
V. Conduz eletricidade em solução aquosa ou
quando fundida.
O mais provável é que X seja:
a) um composto iônico que se dissocia em água;
b) um composto molecular polar que se ioniza
em água;
c) um metal que reage com a água;
d) uma substância apolar que se dissocia em
água;
e) um composto molecular polar que se dissocia
em água.
(a)
9) (USF- SP) Um átomo X da família IIA e outro
átomo Y da família VIIA formarão um composto:
a)
b)
c)
d)
iônico de fórmula X2Y.
molecular de fórmula XY2.
Iônico de fórmula XY2.
molecular de fórmula X2Y.
(c)
10) Os compostos iônicos apresentam as seguintes
propriedades:
01. elevado ponto de ebulição.
02. Geralmente são sólidos.
03. São
geralmente
solúveis
em
água;
apresentam estrutura cristalina e altos
pontos de fusão.
04. Boa condutividade elétrica; solubilidade em
água; são geralmente líquidos.
05. São todos solúveis em solventes polares.
06. Apresentam brilho metálico.
07. São geralmente solúveis em solventes
apolares.
(1, 2, 3 e 5)
11) (Odonto. Diamantina-MG) Considere as fórmulas
e ângulos de ligações dados a seguir:
Fórmula
Ângulo
H2O NH3
CH4
BeH2
105º 107º 109º28' 180º
As formas geométricas dessa moléculas são,
respectivamente:
a)
b)
c)
d)
e)
tetraédrica, tetraédrica, tetraédrica, angular.
Angular, piramidal, tetraédrica, angular.
Angular, piramidal, tetraédrica, linear.
Angular, angular, piramidal, trigonal.
Trigonal, trigonal, piramidal, angular.
(c)
12) A respeito de polaridade em moléculas e suas
formas geométricas, julgue os itens.
(1) Tanto o enxofre (Z=16) quanto o berílio (Z=4)
formam compostos lineares.
(2) O carbono (Z=6), por realizar 4 ligações, pode
aparecer em compostos diferentes com formas
geométricas diferentes, dependendo do tipo de
ligação realizada pelo mesmo.
Fátima Serrado
(3) Embora a ligação entre o nitrogênio e o
hidrogênio seja polar, o composto NH3 é apolar.
(4) O carbono pode formar compostos apolares, o
CCl4 e o CO2, embora tenham geometria
diferentes também.
ECEE
13) Julgue os itens.
(1) A água seria gás, à temperatura ambiente, se
suas moléculas fossem lineares (H – O – H).
(2) A molécula de CF4 é apolar, embora as ligações
C–F sejam polares.
(3) A união entre os átomos de um metal se dá por
meio do compartilhamento de pares de elétrons.
(4) As espécies NH4+ e NH3 têm a mesma geometria.
(5) O CH4 é menos solúvel em CCl4 do que em CHCl3.
(6) No estado líquido, há fortes interações entre as
moléculas de ácido acético (CH3COOH).
CCEEEC
14) A geometria de uma molécula interfere em uma
série de propriedades e características dos
materiais. A esse respeito, julgue os itens.
(1) Dependendo da geometria de uma molécula, ela
pode ser muito solúvel ou não, em um dado
solvente.
(2) A geometria de uma molécula pode determinar
se um material, por ela constituída, pode ser
utilizado em altas temperaturas sem sofrer
transformações de estado físico.
(3) A água possui uma geometria angular, porém, se
os seus átomos estivessem distribuídos de forma
linear, a água não poderia ser utilizada nos
radiadores dos automóveis.
(4) A amônia é um eletrólito forte (bom condutor de
corrente elétrica). Isso não ocorreria se a sua
geometria molecular fosse trigonal plana.
CCCC
Questões de Olimpíadas de Química
1. Quais geometrias são possíveis para uma
molécula do tipo ABn cujo átomo central
apresenta hibridação do tipo sp3?
a) Tetraédrica, piramidal ou em forma de “v”
(angular)
b) Tetraédrica, piramidal ou triangular plana
c) Tetraédrica ou triangular plana
d) Tetraédrica ou piramidal
e) Somente tetraédrica
Resp: (e)
A hibridação sp3, o átomo central tem 4
ligantes, então, sua estrutura será tetraédrica
somente.
2. A geometria molecular de uma espécie química
pode ser prevista a partir do modelo da repulsão
dos pares eletrônicos da camada de valência.
a) Associe cada
geometria.
I. SO2
( )
II. CO2
( )
III. SO3
( )
IV. NH3
( )
espécie química à respectiva
linear
angular
tetraédrica
trigonal planar
-3 -
Química – 1º Ano
V. CH4
VI. XeF4
VII. IF5
VIII. PCl5
(
(
(
(
)
)
)
)
CMB
quadrado planar
pirâmide trigonal
bipirâmide trigonal
pirâmide de base quadrada
b) Distribua as espécies químicas acima em dois
grupos
Grupo A – moléculas apolares
Grupo B – moléculas polares
Resp:
a) I. angular
b) II. linear
H
S
H
O=C=O
O
c) III. trigonal ou trigonal plana
S
H
d) IV. piramidal ou pirâmide trigonal
H
H
e) V. tetraédrica
H
N
H H
C
H
H
H
f) VI. quadrado planar
g) VII. pirâmide de base quadrada
h) VIII. bipirâmide trigonal
3. (OBQ-2008) Através de técnicas criogênicas
podem ser alcançadas temperaturas muito
baixas, tornando possível condensar o hidrogênio
gasoso (em torno de -253oC), obtendo assim
hidrogênio líquido. Desta forma, uma maior
quantidade de hidrogênio pode ser armazenada
e transportada. Quando o hidrogênio retorna do
estado líquido para o estado gasoso ocorre o
rompimento de:
a)
b)
c)
d)
e)
Interações de Van der Waals
Ligações covalentes
Ligações de hidrogênio
Pontes de hidrogênio
As opções (c) e (d) estão corretas.
(e)
4. As geometrias das moléculas BCl3 e PCl5 são,
respectivamente:
a) piramidal e pentaédrica
b) triangular plana e pentaédrica
c) piramidal e bipirâmide de base triangular
d) piramidal e bipirâmide de base quadrada
e) triangular plana e bipirâmide de base
triangular
(e)
Fátima Serrado
-4 -












