EXERCÍCIOS - TABELA PERIÓDICA - 2012
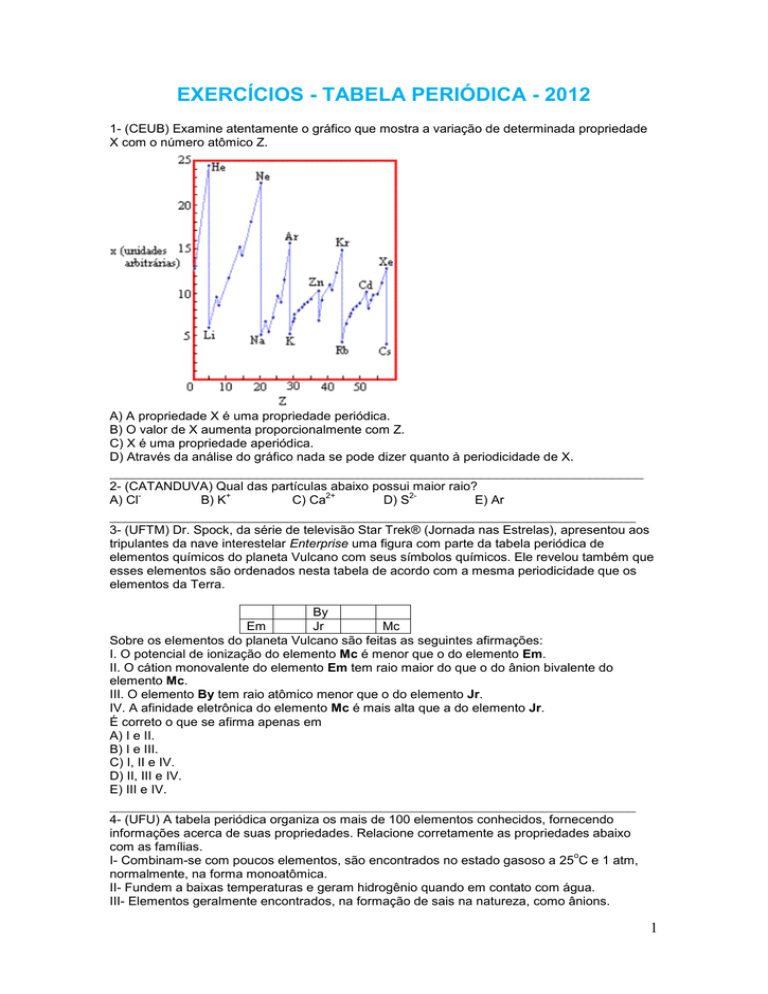
1- (CEUB) Examine atentamente o gráfico que mostra a variação de determinada propriedade
X com o número atômico Z.
A) A propriedade X é uma propriedade periódica.
B) O valor de X aumenta proporcionalmente com Z.
C) X é uma propriedade aperiódica.
D) Através da análise do gráfico nada se pode dizer quanto à periodicidade de X.
_____________________________________________________________________
2- (CATANDUVA) Qual das partículas abaixo possui maior raio?
+
2+
2A) Cl
B) K
C) Ca
D) S
E) Ar
____________________________________________________________________
3- (UFTM) Dr. Spock, da série de televisão Star Trek® (Jornada nas Estrelas), apresentou aos
tripulantes da nave interestelar Enterprise uma figura com parte da tabela periódica de
elementos químicos do planeta Vulcano com seus símbolos químicos. Ele revelou também que
esses elementos são ordenados nesta tabela de acordo com a mesma periodicidade que os
elementos da Terra.
By
Em
Jr
Mc
Sobre os elementos do planeta Vulcano são feitas as seguintes afirmações:
I. O potencial de ionização do elemento Mc é menor que o do elemento Em.
II. O cátion monovalente do elemento Em tem raio maior do que o do ânion bivalente do
elemento Mc.
III. O elemento By tem raio atômico menor que o do elemento Jr.
IV. A afinidade eletrônica do elemento Mc é mais alta que a do elemento Jr.
É correto o que se afirma apenas em
A) I e II.
B) I e III.
C) I, II e IV.
D) II, III e IV.
E) III e IV.
____________________________________________________________________
4- (UFU) A tabela periódica organiza os mais de 100 elementos conhecidos, fornecendo
informações acerca de suas propriedades. Relacione corretamente as propriedades abaixo
com as famílias.
o
I- Combinam-se com poucos elementos, são encontrados no estado gasoso a 25 C e 1 atm,
normalmente, na forma monoatômica.
II- Fundem a baixas temperaturas e geram hidrogênio quando em contato com água.
III- Elementos geralmente encontrados, na formação de sais na natureza, como ânions.
1
(a) Metais alcalinos.
(b) Metais de transição.
(c) Halogênios.
(d) Gases nobres.
A) I (d); II (a); III (c)
B) I (c); II (a); III (b)
C) I (b); II (d); III (a)
D) I (d); II (b); III (c)
E) I (b); II (a); III (c)
____________________________________________________________________
5- (UFSM) Sob o ponto de vista químico, o solo se torna ácido não somente pela oxidação da
matéria orgânica, mas também pela lavagem seletiva de íons pela água. Sais formados pelos
elementos dos grupos 1 e 2 da Tabela Periódica são mais solúveis que os formados pelos
elementos dos outros grupos.
2+
2+
3+
3+
Sabe-se que um solo contendo íons Ca , Mg , Fe ,Al será levemente alcalino. Se houver
2+
2+
lavagem seletiva, haverá, preferencialmente, remoção dos íons Ca e Mg , e o solo se tornará
3+
3+
ácido, porque os íons Fe e Al reagem com a água, de acordo com as equações:
3+
2+
+
Fe + H2O Fe (OH) + H
3+
2+
+
Al + H2O Al (OH) + H
Assinale verdadeira (V) ou falsa (F) em cada afirmativa a seguir.
( ) Os elementos Fe e Al são metais representativos.
3+
( ) O íon Fe tem 2 elétrons na camada de valência.
( ) O elemento neutro Ca tem raio atômico maior que o elemento neutro Mg.
( ) O elemento Mg tem potencial de ionização maior que o elemento Al.
A seqüência correta é
A) V – V – F – F
B) V – F – V – F
C) F – V – F – V
D) F – F – V – F
E) V – V – F – V
____________________________________________________________________
2+
1-
3+
2-
1+
6- (FURG) Os íons A , B , C , D e E
seus números atômicos, é
3+
2+
1+
12A) C < A < E < B < D
211+
2+
3+
B) D < B < E < A < C
213+
2+
1+
C) D < B < C < A < E
121+
2+
3+
D) B < D < E < A < C
23+
2+
11+
E) D < C < A < B < E
são isoeletrônicos. A ordem correta, em relação aos
____________________________________________________________________
7- (FUVEST) Em um bate-papo na Internet, cinco estudantes de química decidiram não revelar
seus nomes, mas apenas as duas primeira letras, por meio de símbolos de elementos
químicos. Nas mensagens, descreveram algumas características desses elementos.
- É produzido, a partir da bauxita, por um processo que consome muita energia elétrica.
Entretanto, parte do que é produzido, após utilização, é reciclado.
- É o principal constituinte do aço. Reage com água e oxigênio, formando um óxido hidratado.
- É o segundo elemento mais abundante na crosta terrestre. Na forma de óxido, está presente
na areia. É empregado em componentes de computadores, .
- Reage com água, desprendendo hidrogênio. Combina-se com cloro, formando o principal
constituinte do sal de cozinha. .
- Na forma de cátion, compõe o mármore e a cal.
Os nomes dos estudantes, na ordem em que estão apresentadas as mensagens, podem ser
(A) Silvana, Carlos, Alberto, Nair. Fernando.
(B) Alberto, Fernando, Silvana, Nair, Carlos.
(C) Silvana, Carlos, Alberto, Fernando, Nair.
(D) Nair, Alberto, Fernando, Silvana, Carlos,
(E) Alberto, Fernando, Silvana, Carlos, Nair.
____________________________________________________________________
8- (UFSM) A muscovita, um tipo de mica, é formada por silicato de potássio e alumínio, tendo a
fórmula K2O . 3 Al2O3 . 6 SiO2 . 2 H2O. Em relação aos elementos neutros Al, Si e K, assinale V
2
(verdadeira) ou F (falsa).
( ) Os três elementos possuem a mesma camada de valência.
( ) O raio atômico de K é maior que o do Al, pois o número de camadas eletrônicas é maior
no K.
( ) O Si tem raio atômico maior que o Al, pois o Si tem mais elétrons.
( ) A densidade do Al é maior que a densidade do Si.
A sequência correta é
A) F – F – V – V
B) V – F – F – F
C) F – V – F – V
D) V – V – V – F
E) F – V – V – V
____________________________________________________________________
9- (PUCRS) Os metais são conhecidos pela sua maleabilidade e ductilidade, por serem bons
condutores térmicos e elétricos e apresentarem brilho característico. Propriedades mais
específicas de alguns metais são descritas a seguir.
O metal I é líquido à temperatura ambiente e dissolve diversos outros metais, formando
amálgamas que apresentam larga aplicação.
O metal II apresenta temperatura de fusão de 98°C, é mole e reage violentamente com a água,
liberando grande quantidade de energia.
O metal III é certamente o metal mais utilizado no mundo, sendo o principal constituinte das
ligas metálicas conhecidas genericamente como aço.
O metal IV tem bastante aplicação na indústria civil e de embalagens. Além de pouco denso,
tem a vantagem de ser coberto por uma fina camada de óxido que dificulta a sua corrosão pelo
oxigênio.
Os metais, I, II, III e IV são, respectivamente,
A) mercúrio, ouro, cobre e titânio.
B) césio, potássio, prata e alumínio.
C) mercúrio, sódio, ferro e alumínio.
D) mercúrio, sódio, cobre e estanho.
E) gálio, ouro, ferro e alumínio.
____________________________________________________________________
10- (UFRGS – Escola Técnica) Com relação às propriedades periódicas, considere as
seguintes afirmações.
I – Os elementos localizados à direita e acima, na classificação periódica, são os que
apresentam maiores raios atômicos.
II – Os metais dos grupos 1 e 2 possuem grande facilidade para doar elétrons e,
consequentemente, apresentam elevados potenciais de ionização.
III – Os halogênios (grupo 17) são os elementos químicos com maior eletroafinidade.
IV – Os não-metais, quando comparados aos metais, são elementos que apresentam menores
raios atômicos e tendência para formarem ânions.
Quais são as afirmações corretas ?
A) Apenas a I e a II
B) Apenas a I, a II e a III
C) Apenas a II, a III e a IV
D) Apenas a II e a IV
E) Apenas a III e a IV
____________________________________________________________________
11- (PUCRS) Os elementos que apresentam as características a seguir,
I - Têm baixos pontos de ebulição.
II - Formam ânions.
III - Em geral são muito eletronegativos.
podem ser representados por
A) H, Ca, Li, Ag.
B) He, C, I, Pb.
C) P, Ne, O, Se.
D) N, Si, Ar, K.
E) Br, S, Cl, F.
3
12- (PUCRS) Em geral, os fertilizantes usados na agricultura contém os elementos químicos
potássio, fósforo e nitrogênio na forma de óxidos ou sais. Em relação a esses elementos
afirma-se que
(A) são sólidos nas condições normais de T e P.
(B) possuem tendência de compartilhar elétrons quando estão combinados.
(C) estão localizados no mesmo período da tabela.
(D) estão apresentados em ordem crescente de eletronegatividade.
(E) são classificados, respectivamente, em metal, semimetal e não-metal.
____________________________________________________________________
13- (PUCRS) Na coluna da esquerda estão relacionados elementos químicos que podem ou
não estar relacionados às características apresentadas na coluna da direita.
1. bário
a. tem elevada densidade.
2. alumínio
b. tem elevada energia de ionização.
3. enxofre
c. pertence ao mesmo grupo do boro.
4. platina
d. é elemento de transição.
e. é elemento alcalino-terroso
Existem associações corretas somente em
A) 1 - a; 2 - b; 3 - c; 4 - d.
B) 1 - c; 2 - b; 3 - e; 4 - d.
C) 1 - e; 2 - c; 3 - d; 4 - a.
D) 1 - d; 2 - a; 3 - b; 4 - c.
E) 1 - e; 2 - c; 3 - b; 4 - a.
____________________________________________________________________
14- (PUCRS) A característica que pertence ao elemento químico de maior eletronegatividade é
a da alternativa
0
A) está localizado no 2 período e no grupo dos metais alcalinos.
B) pertence ao grupo 8 e é utilizado como medicamento para combater a anemia.
C) é lantanídio e possui 63 prótons, 63 elétrons e 89 nêutrons.
D) está localizado no grupo 14 e, na forma de óxido, entra na composição química da areia.
E) é um importante halogênio aplicado na prevenção da cárie dentária.
____________________________________________________________________
15- (PUCRS) Com base na classificação periódica dos elementos, pode-se afirmar que na
família dos calcogênios, com o aumento do número atômico, ocorre
A) o aumento do potencial de ionização.
B) a diminuição do número de níveis de energia.
C) o aumento da eletronegatividade.
D) a diminuição do ponto de ebulição.
E) o aumento da raio atômico.
____________________________________________________________________
16- (PUCRS) Considerando a Classificação Periódica dos elementos, é correto afirmar que
A) elementos de mesmo período possuem diferentes níveis de energia.
B) os metais alcalinos possuem menores valores de potenciais de ionização.
C) a eletropositividade dos metais alcalino-terrosos aumenta com a diminuição do número
atômico.
D) os halogênios apresentam baixos valores de eletronegatividade.
E) os calcogênios são todos classificados como não-metais.
____________________________________________________________________
17- (UERGS) Os metais são muito importantes para o metabolismo do corpo humano. O ferro,
presente na hemoglobina,é responsável pelo transporte do oxigênio no sangue; o cobalto entra
na composição das vitaminas; o manganês, o molibdênio, o zinco e o cromo estão presentes
na estrutura de enzimas que regulam o metabolismo do organismo.
Os elementos químicos acima citados podem ser classificados como
A) metais de transição.
B) metais alcalinos terrosos.
C) metais alcalinos.
D) calcogênios.
E) halogênios.
____________________________________________________________________
4
18- (UERGS) Considere os seguintes elementos químicos representados pelas letras A, B, C e
D e as afirmações feitas sobre eles:
A: pertence ao 2° período e ao 15° grupo da tabela periódica.
B: pertence ao 3° período e ao 1° grupo da tabela periódica.
C: pertence ao 3° período e ao 13° grupo da tabela periódica.
D: pertence ao 4° período e ao 1° grupo da tabela periódica.
A alternativa que apresenta esses elementos em ordem crescente de raios atômicos é
A) A - B - C - D
B) A - C - B - D
C) D- C - B - A
D) B - C - D - A
E) C - A - B - D
____________________________________________________________________
19- (UPF) Assinale a alternativa incorreta em relação ao tamanho de átomos ou íons:
+
A) 11Na > 11Na
B) 12Mg > 13Al > 32S
-2
C) 8O < 9F
2+
+
D) 20Ca < 19K
E) 17Cl < 17Cl
____________________________________________________________________
20- (UPF) Analise os seguintes itens:
I – metal que reveste o cátodo das lâmpadas de iluminação de rua;
II – metal presente nas latas de conserva;
III – poluente presente na gasolina de alta octanagem;
IV – gás presente nos luminosos de lojas.
Os elementos químicos relacionados com cada um desses itens são, respectivamente:
A) Mg , Fe , As , O2
B) Hg , Pb , Co , H2
C) Ni , Sb , Po , N2
D) K , Al , U , Ag
E) Na , Sn , Pb , Ne
____________________________________________________________________
21- (UPF) Considere as seguintes aplicações:
I – utilizado como combustível em reatores nucleares;
II – utilizado em ligas metálicas como latão;
III – utilizado em tratamento de água;
IV – utilizado em medicamentos e antissépticos;
Os elementos químicos que correspondem a essas aplicações, na ordem em que elas vêm
relacionadas, são:
A) Fr , Al , Na , Pb
B) U , Zn , Cl2 , I2
C) Pu , Pt , Br2 , N2
D) V , Au , O2 , As
E) Re , Eu , F2 , B
_____________________________________________________________________
22- “De todos os materiais recicláveis os metais são, sem dúvida, um dos mais vantajosos e
lucrativos, pois, podem ser reciclados diversas vezes sem perder suas propriedades”. Os
metais recicláveis podem ser divididos em dois grupos: Metais ferrosos e metais não ferrosos.
Os metais não ferrosos, no entanto, são mais rentáveis e sua reciclagem é mais destacada. A
grande estrela dos metais não ferrosos é o alumínio (Al: Z = 13).
Sobre o texto e temas relativos, assinale a alternativa incorreta.
A) Os metais constituem a maioria dos elementos químicos.
B) O alumínio é um elemento químico que se localiza na família 13.
C) Encontraremos o alumínio no 3º período da classificação periódica.
D) Podemos afirmar que o alumínio é um elemento que possui 3 elétrons na sua camada mais
energética.
E) Outros metais não ferrosos são: cobre e chumbo, que também são metais representativos
da tabela periódica.
_____________________________________________________________________
5
23- (UFRGS) Uma das características dos gases nobres é:
A) apresentarem sempre 8 elétrons na última camada.
B) não serem passíveis de liquefação.
C) reagem com metais nobres, como a prata e o ouro.
D) serem elementos artificiais.
E) possuem baixa reatividade química.
___________________________________________________________________
24- Considere as seguintes proposições a seguir:
I – Para elementos da coluna 1, os potencias de ionização aumentam de baixo para cima.
II – Os elementos de potenciais de ionização mais elevados são da coluna 17.
III – Para os elementos de uma mesma coluna, o raio atômico cresce com o aumento do
número de camadas.
IV – O cátion de metal alcalino tem mesma configuração eletrônica que o gás nobre do mesmo
período.
V – Na coluna 16, a medida que aumenta o número atômico dos elementos, a
eletronegatividade diminui.
São proposições corretas:
A) I, II e V
B) I, III e IV
C) I, III e V
D) II, III e V
E) III, IV e V
_____________________________________________________________________
25- Observe a tabela periódica esquematizada abaixo:
E
D
A B
C
Sobre os elementos representados pelas letras A, B, C, D e E é incorreto afirmar que:
A) o elemento A possui raio atômico maior que o elemento B.
B) o elemento C é um ametal menos eletronegativo que o elemento D.
C) o elemento B possui energia de ionização menor que o elemento E.
D) o elemento D possui menor raio atômico que o elemento C.
E) o elemento E por ter menor raio atômico perde elétrons mais facilmente que o elemento C.
_____________________________________________________________________
26- A maioria dos alimentos que o ser humano precisa ingerir para sua sobrevivência pertence
a três grupos de compostos orgânicos, conhecidos como carboidratos, gorduras e proteínas.
Esses alimentos também devem conter substâncias que possuam elementos químicos como
potássio, magnésio, fósforo, iodo, cálcio e ferro.
Sobre os elementos citados no texto, assinale a alternativa incorreta.
A) Apenas um dos elementos corresponde a um metal de transição.
B) O potássio é o elemento que mais facilmente cederá um elétron.
C) Magnésio e cálcio são metais alcalinos-terrosos.
D) O cálcio tem maior energia de ionização que o magnésio.
E) Apenas dois deles não são metais.
_____________________________________________________________________
27- Para responder a questão abaixo, julgue os itens.
Os metais são substâncias que apresentam elevada condutividade elétrica, brilho metálico,
ductibilidade (capacidade de ser estirado em fios), maleabilidade (capacidade de ser rogado
em folhas finas) e geralmente elevado ponto de fusão. O cristal metálico é envolvido por uma
nuvem eletrônica deslocalizada (elétrons livres) que é responsável por essas propriedades
físicas. Esse modelo de cristal metálico relaciona- se com as afirmativas:
I. Os átomos do metal estão fracamente ligados com o(s) seu(s) elétron(s) de valência.
II. A energia de ionização é elevada.
III. As propriedades químicas dos metais estão também relacionadas com a baixa
eletronegatividade.
Está correto o que se afirma em:
6
A) apenas I.
B) apenas II.
C) apenas III.
D) apenas I e III.
E) apenas II e III.
_____________________________________________________________________
28- Um dos fatores que favorecem a solubilidade de um metal em outro é a semelhança de
suas redes cristalinas. No entanto é preciso, também, que os seus átomos não sejam muito
diferentes quanto a:
- raio atômico;
- eletronegatividade;
- valência.
Os metais alcalinos e o ferro, que apresentam redes cristalinas semelhantes, não formam ligas
por causa das grandes diferenças quanto a essas propriedades.
Considerando-se as propriedades periódicas do ferro e dos metais alcalinos, é incorreto
afirmar que:
A) a eletronegatividade do átomo de ferro é maior que a do átomo de sódio.
B) o número de oxidação mais comum dos metais alcalinos é +1.
C) o raio atômico do ferro é maior que o do potássio.
D) o raio atômico do ferro é menor que o do rubídio.
E) a eletropositividade do ferro é menor que a do potássio.
_____________________________________________________________________
29- Alguns minerais encontrados nos alimentos, quando absorvidos pelo organismo, são
utilizados em diversas funções essenciais para seu funcionamento. São denominados
macronutrientes aqueles elementos essenciais que devem ser consumidos em quantidades na
ordem de 100 mg por dia. Dentre os macronutrientes estão quatro elementos pertencentes ao
mesmo período da tabela periódica. No quadro são apresentadas algumas propriedades
desses elementos, designados por I, II, III e IV.
Os elementos I, II, III e IV são, respectivamente:
A) Mg, Cl, Na e P.
B) P, Mg, Na e Cl.
C) Cl, P, Mg e Na.
D) Na, Mg, P e Cl.
E) P, Na, Cl e Mg.
_____________________________________________________________________
30- (UFF) Analisando-se a classificação periódica dos elementos químicos, pode-se afirmar
que:
A) O raio atômico do nitrogênio é maior que o do fósforo.
B) A afinidade eletrônica do cloro é menor que a do fósforo.
C) O raio atômico do sódio é menor que o do magnésio.
D) A energia de ionização do alumínio é maior que a do enxofre.
E) A energia de ionização do sódio é maior que a do potássio.
____________________________________________________________________
31- Entre os pares de elementos, o par que reúne elementos com propriedades químicas mais
semelhantes é
A) Na e K
B) Cl e Ar
C) Ca e Cu
D) F e Ba
E) H e I
_____________________________________________________________________
7
32- Considere as seguintes afirmativas sobre propriedades periódicas:
+2
I – A energia de ionização do Mg é maior que a do Ne.
II – A eletronegatividade do B é maior que a do Al.
III – O átomo de ferro metálico tem maior raio que o átomo de níquel metálico.
IV – O bário perde elétrons com maior facilidade que o cálcio.
Estão corretas?
A) I, II e IV
B) I e III
C) II, III e IV
D) II e III
E) I, II, III e IV
____________________________________________________________________
33- O gráfico abaixo mostra a variação do potencial de ionização (eixo das ordenadas) em
função do número atômico (eixo das abscissas). Considerando que a escala no eixo das
abscissas não começa necessariamente de zero, os números atômicos dos elementos A, B e C
só podem ser, respectivamente:
A) A = 1; B = 9; C = 10.
B) A = 11; B = 18; C = 19.
C) A = 10; B = 19; C = 20.
D) A = 12; B = 17; C = 18.
E) A = 2; B = 10; C = 11.
_____________________________________________________________________
34- (UFRGS) Comparando-se átomos neutros de Na, K, F e CI é possível afirmar-se que
A) o raio atômico do potássio é menor do que o do cloro.
B) o potássio é menos eletropositivo do que o sódio.
C) flúor e potássio são os mais eletronegativos.
D) o sódio e o cloro apresentam raios atômicos iguais.
E) o potencial de ionização do flúor é maior do que o do cloro.
_____________________________________________________________________
35- (PUCRS) Responder a esta questão a partir da análise das seguintes afirmativas.
+
I. Um átomo A e seu cátion A possuem o mesmo raio.
II. Um átomo X possui raio maior do que o do seu ânion X .
III. O átomo de oxigênio apresenta potencial de ionização maior do que o do átomo de enxofre.
+
2IV. O íon Li apresenta raio menor que o íon O .
Estão corretas as afirmativas apresentadas na alternativa
A) I e II
B) I e III
C) II e III
D) II e IV
E) III e IV
_____________________________________________________________________
36- (UFRGS) Considerando-se elementos do 3° período da classificação periódica é correto
afirmar que a energia de ionização apresentada pelo metal alcalino
8
A) é maior que a do halogênio.
B) é menor que a do calcogênio.
C) é maior que a do metal alcalino terroso.
D) é igual à dos demais elementos do período.
E) é maior que a do gás nobre.
_____________________________________________________________________
37- (PUCRS) Responder a esta questão a partir da tabela a seguir que apresenta os raios
atômicos e iônicos de alguns elementos genéricos
ELEMENTO
GENÉRICO
I
II
III
IV
ATÔMICO (A)
1,57
0,66
1,06
2,03
IÔNICO (A)
0,95
1,40
1,74
1,33
RAIO
O exame da tabela mostra que, nesses casos, formam ânions os elementos genéricos
A) I e II
B) I e III
C) I e IV
D) II e III
E) III e IV
_____________________________________________________________________
38- Considere as seguintes características:
- tem baixa eletronegatividade;
- ao perder elétrons, torna-se isoeletrônico do argônio;
- seu raio iônico é menor que seu raio atômico.
Essas características podem pertencer ao elemento químico
A) sódio.
B) cloro.
C) enxofre.
D) cálcio.
E) magnésio.
____________________________________________________________________
39- Observe as configurações eletrônicas dos íons dos elementos representados por X, Y e Z.
ÍONS
CONFIGURAÇÃO ELETRÔNICA
–2
X
K=2 L=8 M=8
–
Y
K=2 L=8 M=18 N=8
+2
Z
K=2 L=8 M=8
Considerando os raios atômicos e/ou iônicos, assinale a alternativa que apresenta a
proposição correta:
+2
–
+2
A) X > Z
B) Y < Y
C) Z < X
D) Z < Z
E) Z < Y
_____________________________________________________________________
40- (PUCRS) Pelo exame das afirmativas
I – O calcogênio de menor volume atômico é o polônio.
II – O metal alcalino-terroso de menor eletropositividade é o rádio.
III – O elemento do quarto período de maior potencial de ionização é o criptônio.
IV – O metal alcalino menos eletronegativo é o frâncio.
conclui-se que estão de acordo com a Classificação Periódica dos Elementos as afirmativas da
alternativa
A) I e II
B) I e III
C) II e III
D) II e IV
E) III e IV
_____________________________________________________________________
41- (UFSM) Comparando-se a afinidade eletrônica do cloro e do bromo, pode-se afirmar que
ela
A) é maior para o cloro, pois ele possui menor número de camadas eletrônicas.
B) é maior para o bromo, porque ele possui menor raio atômico.
C) é igual, pois eles não pertencem ao mesmo período.
D) é menor para o cloro, pois ele tem tendência a formar íons negativos.
E) é igual, pois eles pertencem ao mesmo grupo.
_____________________________________________________________________
42- (UFRGS) Uma dada espécie química que apresenta distribuição eletrônica
K=2e
L=8e
M=8e
pode ser um
A) átomo neutro de um metal alcalino do terceiro período.
B) cátion derivado de metal alcalino do quarto período.
C) ânion derivado de halogênio do quarto período.
D) ânion derivado de calcogênio do segundo período.
9
E) átomo neutro de gás nobre do quarto período.
_____________________________________________________________________
43- (UFSM) O ouro, um dos primeiros elementos descobertos pelo homem, foi usado por
alguns povos na antiguidade como material para escrever.
Analise as afirmativas em relação ao elemento ouro.
I- Tem raio atômico maior que o raio dos elementos Cu e Ag, por possuir mais camadas
eletrônicas.
II- Encontra-se no 5º período da tabela periódica.
III- Tem características metálicas.
Está(ão) correta(s)
A) apenas I.
B) apenas II.
C) apenas III.
D) apenas I e III.
E) apenas II e III.
_____________________________________________________________________
44- (UFSM) A argila, da qual foram feitos os potes, tem como constituinte principal o silicato de
alumínio hidratado.
Em relação aos elementos alumínio e silício, analise as seguintes afirmativas:
I. Ambos são classificados como elementos representativos.
II. O alumínio possui 3 elétrons na camada de valência.
III. O raio atômico do silício é maior que o do alumínio, pois o silício possui mais elétrons na
camada de valência que o alumínio.
Está(ão) correta(s)
A) I apenas.
B) II apenas.
C) III apenas.
D) I e II apenas.
E) II e III apenas.
_____________________________________________________________________
45- (UFSM) Analise os elementos presentes nos constituintes do sal de cozinha, NaCl e KI, e
coloque verdadeira (V) ou falsa (F) em cada afirmativa.
( ) Os quatro elementos químicos são classificados como representativos.
( ) No estado elementar, o raio atômico do Cl é maior que o raio atômico do Na.
( ) Os elementos Na e K são metálicos.
( ) Os elementos Na e Cl têm o mesmo número de elétrons na última camada.
A sequência correta é
A) V - V - V - F.
B) V - V - F - F.
C) V - F - V - F.
D) F - V - F - V.
E) F - F - F - V.
_____________________________________________________________________
46- (UFSM) Zinco, selênio, ferro e fósforo são sais minerais que participam de inúmeras trocas
elétricas e mantêm o cérebro acordado e ativo. Estão presentes em sementes e grãos, raízes e
folhas verde-escuras.
Em relação ao elemento selênio, analise as afirmativas:
I - Possui 6 elétrons na camada de valência.
II - Devido à sua afinidade eletrônica alta, recebe, usualmente, dois elétrons e forma um ânion
divalente.
III - É classificado como um metal.
Está(ão) correta(s)
A) apenas I.
B) apenas II.
C) apenas III.
D) apenas I e II.
E) apenas II e III.
_____________________________________________________________________
47- (UFSM) Em relação aos elementos oxigênio, fósforo e selênio, assinale verdadeira (V) ou
falsa (F) em cada uma das afirmativas.
10
( ) O raio atômico do oxigênio é menor que o do selênio, pois o primeiro tem menor número de
camadas eletrônicas.
( ) O oxigênio perde elétrons com mais facilidade que o selênio.
( ) O oxigênio é mais eletronegativo que o fósforo.
A sequência correta é
A) F - V - F.
B) V - F - V.
C) F - F - V.
D) V - F - F.
E) V - V - F.
_____________________________________________________________________
48- (UFSM) A lâmpada de sódio, utilizada nas cidades, emite luz amarela, produzida pela
excitação dos elétrons nos átomos de sódio.
Em relação ao elemento neutro sódio, analise as afirmativas:
I- Pertence ao terceiro período da tabela periódica.
II- Tende a receber um elétron e a se tornar um cátion.
III- Apresenta potencial de ionização baixo.
Está(ão) correta(s)
A) apenas II.
B) apenas III.
C) apenas I e II.
D) apenas I e III.
E) I, II e III.
_____________________________________________________________________
1-A
13-E
25-E
37-D
2-D
14-E
26-D
38-D
3-E
15-E
27-D
39-D
4-A
16-B
28-C
40-E
5-D
17-A
29-A
41-A
6-B
18-B
30-E
42-B
7-B
19-C
31-A
43-D
8-C
20-E
32-E
44-D
9-C
21-B
33-B
45-C
10-E
22-E
34-E
46-D
11-E
23-E
35-E
47-B
12-D
24-C
36-B
48-D
_____________________________________________________________________
11












